化学的知识点几乎都是从实验中得来的。下面是小编为您整理的9年级化学知识点归纳。希望对各位有所帮助。

9年级化学知识点归纳(一)
溶液组成的表示方法
(1)溶液的组成:溶质和溶剂。
(2)浓溶液、稀溶液:在一定量的溶剂里所含的溶质多为浓溶液,所含的溶质少为稀溶液。溶液的“浓、稀”只是溶液组成的一种粗略表示方法。溶液的“浓、稀”与饱和不饱和无关,即浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
溶液体积与溶液质量的关系:溶液质量=溶液体积×溶液密度。
溶解度概念:
在一定温度下,某固体物质在100g溶剂里达到饱和状态时,所溶解溶质的质量,叫做这种物质在这种溶解里的溶解度。
溶解度曲线变化的规律
大多数固体物质的溶解度随温度的升高而增大,一般表现在曲线“坡度”比较“陡”,如硝酸钾;少数固体物质的溶解度受温度的影响较小,表现在曲线的“坡度”比较“平缓”,如氯化钠;极少数固体物质的溶解度随温度的升高而减小,表现在曲线的“坡度”下降,如熟石灰。
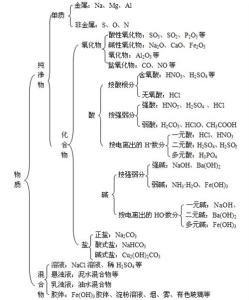
9年级化学知识点归纳(二)盐的溶解性
含有钾、钠、硝酸根、铵根的物质都溶于水
含Cl的化合物只有AgCl不溶于水,其他都溶于水;
含SO42- 的化合物只有BaSO4 不溶于水,其他都溶于水。
含CO32- 的物质只有K2CO3、Na2CO3、(NH4)2CO3溶于水,其他都不溶于水
碱的溶解性
溶于水的碱有:氢氧化钡、氢氧化钾、氢氧化钙、氢氧化钠和氨水,其他碱不溶于水。难溶性碱中Fe(OH)3是红褐色沉淀,Cu(OH)2是蓝色沉淀,其他难溶性碱为白色。(包括Fe(OH)2)
注意:沉淀物中AgCl和BaSO4 不溶于稀硝酸,
其他沉淀物能溶于酸。如:Mg(OH)2 CaCO3 BaCO3 Ag2 CO3 等
酸的溶解性
大部分酸及酸性氧化物能溶于水,(酸性氧化物+水→酸)大部分碱性氧化物不溶于水,能溶的有:氧化钡、氧化钾、氧化钙、氧化钠(碱性氧化物+水→碱)
9年级化学知识点归纳(三)溶质质量分数
定义:溶液中溶质质量与溶液质量的比值叫做溶质的质量分数。
数学表达式:溶质质量分数(ω)
化学方程式与溶质质量分数的综合计算
化学方程式表示的是纯净物之间的质量关系,而溶液是混合物,参加化学反应的是溶液中的溶质,所以应求出参加反应的溶质的质量代入化学方程式计算,或求出生成物溶质质量进行计算。
命题主旨往往以混合物(杂质不参加反应,可能作为生成物列入计算溶液的溶质质量分数)与某溶液反应,根据产生的气体(有时运用质量守恒定律确定)或生成的沉淀的质量来确定混合物中该物质的含量,并计算生成物溶液中溶质的质量分数。
注意:在化学反应中溶液的质量=反应前所加各物质的质量总和-反应后生成沉淀的质量-反应后逸出的气体的质量。
9年级化学知识点归纳(四)饱和溶液:
在一定温度下,一定量的溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。
不饱和溶液:
在一定温度下,一定量的溶剂里,还能再溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
油水混合
向一个透明的小玻璃瓶中注入半瓶清水,再倒进一些菜油。这时候,油 漂在水面上,界限分明。用手摇晃玻璃瓶,强迫油和水混合,静置一会儿,油和水又分成上下两层。这时再往小玻璃瓶里加一点洗涤剂(或洗衣粉),然后充分摇晃瓶子,再观察,就可以看出油和水不再分为两层,而是混合在 一起了。
这是为什么呢?原来洗涤剂有个特属性质,能把一个个油滴包围起来,均匀地分散在水中,这种作用叫“乳化作用”。在这种作用下形成的油水混合液叫“乳油液”。人们喝的牛奶、乳白色的鱼肝油都是乳油液。洗衣粉能去除衣服上的油污,洗涤剂能清洗油泥,就是因为它们跟油和水的关系都不 错,能把油污从衣服上拉到水中来的原故。
 爱华网
爱华网