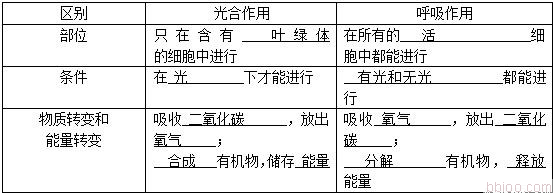
做高考化学选择题最好一遍做对,不要等着后面来检查。下面是由小编为您带来的2016电化学高考知识点分析,欢迎翻阅。
2016电化学高考知识点分析(一)(1)由组成原电池的两极材料判断:一般来说,较活泼的或能和电解质溶液反应的金属为负极,较不活泼的金属或能导电的非金属为正极。但具体情况还要看电解质溶液,如镁、铝电极在稀硫酸在中构成原电池,镁为负极,铝为正极;但镁、铝电极在氢氧化钠溶液中形成原电池时,由于是铝和氢氧化钠溶液发生反应,失去电子,因此铝为负极,镁为正极。Fe 、Cu 和浓HNO3 。
(2)根据外电路电流的方向或电子的流向判断:在原电池的外电路,电流由正极流向负极,电子由负极流向正极。
(3)根据内电路离子的移动方向判断:在原电池电解质溶液中,阳离子移向正极,阴离子移向负极。
(4)根据原电池两极发生的化学反应判断:原电池中,负极总是发生氧化反应,正极总是发生还原反应。因此可以根据总化学方程式中化合价的升降来判断。
(5)根据电极质量的变化判断:原电池工作后,若某一极质量增加,说明溶液中的阳离子在该电极得电子,该电极为正极,活泼性较弱;如果某一电极质量减轻,说明该电极溶解,电极为负极,活泼性较强。
(6)根据电极上产生的气体判断:原电池工作后,如果一电极上产生气体,通常是因为该电极发生了析出氢的反应,说明该电极为正极,活动性较弱。
(7)根据某电极附近pH的变化判断
析氢或吸氧的电极反应发生后,均能使该电极附近电解质溶液的pH增大,因而原电池工作后,该电极附近的pH增大了,说明该电极为正极,金属活动性较弱。
2016电化学高考知识点分析(二)1. 金属的电化学腐蚀
由原电池反应可知,在电化学腐蚀中较活泼金属被氧化腐蚀掉。钢铁的电化学腐蚀有2种:
1)析氢腐蚀 在酸性溶液中发生
负极(Fe):
正极(C):
2)吸氧腐蚀 在中性或酸性极弱的溶液中发生

负极(Fe):
正极(C):
结合生成
铁锈的成分为。钢铁的腐蚀以吸氧腐蚀为主。为防止金属的腐蚀常采用以下措施:(1)改变金属的结构,如铁中加入Cr或Ni制成不锈钢;(2)涂保护层,如搪瓷、喷漆、刷铝粉、镀锌制成白铁皮、镀锡制成马口铁等;(3)连接活泼金属法,即牺牲阳极的阴极保护法,如闸门、轮船连上锌块或锌皮等。
2. 电极产物的判断
原电池:正极发生还原反应,负极发生氧化反应
电解池:阳极发生氧化反应,阴极发生还原反应
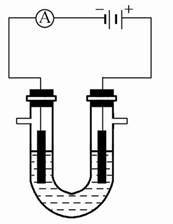
2016电化学高考知识点分析(三)1.电化学装置中都有两个电极,分别发生氧化反应与还原反应。若两个电极插在同一电解质溶液的容器内,则由于阴阳离子的移动速率不同而导致两极之间出现浓度差,以及因电极本身直接与离子反应而导致两极之间电势差变小,影响了电流的稳定。为解决这个问题,人们使用了盐桥。盐桥主要出现在原电池中,有时也可在电解池中出现,其主要作用就是构建闭合的内电路,但不影响反应的实质。盐桥内常为饱和氯化钾、硝酸钾等溶液。
2.盐桥是新课改教材中出现的新名词,因而围绕盐桥的电化学知识已成为新课改地区命题的一个热点,所以有必要分析研究盐桥问题的考查思路。通常从以下四个方面命题。
(1)考查盐桥的作用。
(2)考查含盐桥的电化学总反应式的书写。
(3)考查盐桥内溶液离子的移动方向。
(4)考查含盐桥的电化学装置的设计。
(5)考查盐桥的作用与平衡移动。
 爱华网
爱华网