做好高考的复习,是战胜高考的重要途径。下面是小编为大家收集整理的高考化学知识点归纳,相信这些文字对你会有所帮助的。
高考化学知识点归纳(一)一. 离子反应发生的条件
1. 离子反应生成微溶物或难溶物。
2. 离子反应生成气体。
3. 离子反应生成弱电解质。
4. 离子反应发生氧化还原反应。
根据化学反应类型,离子反应可分为两类,一是酸碱盐之间的复分解反应;二是氧化性离子与还原性离子间的氧化还原反应。离子反应还应注意:
1.微溶物向难溶物转化,如用煮沸法软化暂时硬水
MgHCO3==MgCO3+CO2↑+H2O
MgCO3虽然难溶,但在溶液中溶解的哪部分是完全电离的,当Mg2+遇到水溶液里的OH-时会结合生成比MgCO3溶解度更小的Mg(OH)2而沉淀析出。
MgCO3+H2O==Mg(OH)2 ↓+ CO2↑
2.生成络离子的反应:
FeCl3溶液与KSCN 溶液的反应:Fe3+ + SCN- ==Fe(SCN)2+ 生成物既不是沉淀物也不是气体,为什么反应能发生呢?主要是生成了难电离的Fe(SCN)2+络离子。
3.优先发生氧化还原反应:
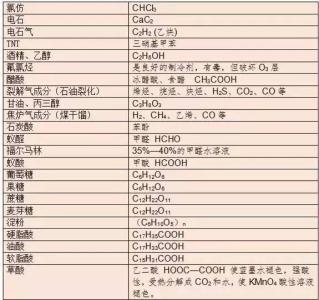
具有强氧化性的离子与强还原性的离子相遇时首先发生氧化还原反应。例如:Na2S溶液与FeCI3溶液混合,生成S和Fe2+离子,而不是发生双水解生成Fe(OH)3沉淀和H2S气体。
2Fe3+ + S2- = 2Fe2+ + S ↓
总之:在水溶液里或在熔融状态下,离子间只要是能发生反应,总是向着降低离子浓度的方向进行。反之,离子反应不能发生。
二. 离子反应的本质:反应体系中能够生成气、水(难电离的物质)、沉淀的离子参与反应,其余的成分实际上未参与反应。
三.离子反应方程式的类型
1. 复分解反应的离子方程式。
2. 氧化还原反应的离子方程式。
3. 盐类水解的离子方程式。
4. 络合反应的离子方程式。
掌握离子方程式的类型及特征,才能书写好离子方程式,正确书写、判断离子方程式是学生必须掌握的基本技能。
高考化学知识点归纳(二)1、 加热碳酸氢钠固体,使生成气体通入澄清石灰水:澄清石灰水变浑浊。
2、 氨气与氯化氢相遇:有大量的白烟产生。
3、 加热氯化铵与氢氧化钙的混合物:有刺激性气味的气体产生。
4、 加热盛有固体氯化铵的试管:在试管口有白色晶体产生。
5、 无色试剂瓶内的浓硝酸受到阳光照射:瓶中空间部分显棕色,硝酸呈黄色。
6、 铜片与浓硝酸反应:反应激烈,有红棕色气体产生。
7、 铜片与稀硝酸反应:试管下端产生无色气体,气体上升逐渐变成红棕色。
8、 在硅酸钠溶液中加入稀盐酸,有白色胶状沉淀产生。
9、 在氢氧化铁胶体中加硫酸镁溶液:胶体变浑浊。
10、加热氢氧化铁胶体:胶体变浑浊。
11、将点燃的镁条伸入盛有二氧化碳的集气瓶中:剧烈燃烧,有黑色物质附着于集气瓶内壁。
12、向硫酸铝溶液中滴加氨水:生成蓬松的白色絮状物质。
13、向硫酸亚铁溶液中滴加氢氧化钠溶液:有白色絮状沉淀生成,立即转变为灰绿色,一会儿又转变为红褐色沉淀。
14、向天然水中加入少量肥皂液:泡沫逐渐减少,且有沉淀产生。
15、在空气中点燃甲烷,并在火焰上放干冷烧杯:火焰呈淡蓝色,烧杯内壁有液滴产生。
16、光照甲烷与氯气的混合气体:黄绿色逐渐变浅,时间较长,(容器内壁有液滴生成)。
17、加热(℃)乙醇与浓硫酸的混合物,并使产生的气体通入溴水,通入酸性高锰酸钾溶液:有气体产生,溴水褪色,紫色逐渐变浅。
18、在空气中点燃乙烯:火焰明亮,有黑烟产生,放出热量。
19、在空气中点燃乙炔:火焰明亮,有浓烟产生,放出热量。
20、苯在空气中燃烧:火焰明亮,并带有黑烟。
21、乙醇在空气中燃烧:火焰呈现淡蓝色。
22、将乙炔通入溴水:溴水褪去颜色。
23、将乙炔通入酸性高锰酸钾溶液:紫色逐渐变浅,直至褪去。
24、苯与溴在有铁粉做催化剂的条件下反应:有白雾产生,生成物油状且带有褐色。
25、将少量甲苯倒入适量的高锰酸钾溶液中,振荡:紫色褪色。
26、将金属钠投入到盛有乙醇的试管中:有气体放出。
27、在盛有少量苯酚的试管中滴入过量的浓溴水:有白色沉淀生成。
28、在盛有苯酚的试管中滴入几滴三氯化铁溶液,振荡:溶液显紫色。
29、乙醛与银氨溶液在试管中反应:洁净的试管内壁附着一层光亮如镜的物质。
30、在加热至沸腾的情况下乙醛与新制的氢氧化铜反应:有红色沉淀生成。
31、在适宜条件下乙醇和乙酸反应:有透明的带香味的油状液体生成。
32、蛋白质遇到浓HNO溶液:变成黄色。
33、紫色的石蕊试液遇碱:变成蓝色。
 爱华网
爱华网