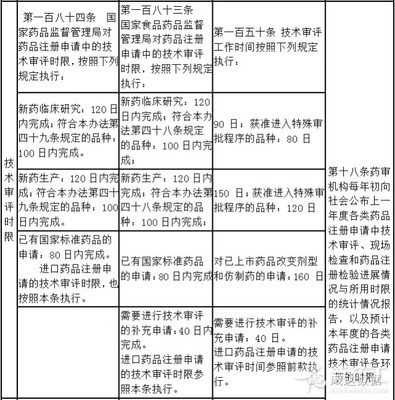
药品注册,是指国家食品药品监督管理局根据药品注册申请人的申请,依照法定程序,对拟上市销售药品的安全性、有效性、质量可控性等进行审查,并决定是否同意其申请的审批过程。
我国建立药品注册管理制度的时间比较短,大体划分为五个阶段:
第一阶段:1963年10月25日,由卫生部、化工部、商业部颁发《关于药品管理的若干规定》,要求对药品实行审批制度。
第二阶段:1966年至1976年期间,全民大搞中草药运动,兴办药厂,药品审批处于混乱状态。
第三阶段:1978年国务院颁布《药政管理条例》,规定新药由省、自治区、直辖市卫生厅(局)和医药管理局组织鉴定后审批;
第四阶段:1984年全国六届人大七次会议审议通过《中华人民共和国药品管理法》,并于1985年5月1日实施。《药品管理法》的颁布,使我国的药品注册管理制度第一次以法律的形式固定下来。同年7月1日,卫生部颁布并实施了《新药审批办法》。
第五阶段:
1998年3月,国家药品监督管理局成立,修订了《新药审批办法》,于1999年5月1日开始实施。
2002年12月1日,国家食品药品监督管理局颁布实施了《药品注册管理办法》(试行)。
2005年2月28日,SFDA颁布了新修订的《药品注册管理办法》。
2007年10月1日起施行新的《药品注册管理办法》(局令28号)。
现行的最新药品注册分类办法是2007版(局令28号),该办法化药、中药和天然药物、生物制品具体分类如下:
一、化学药品注册分类
1.未在国内外上市销售的药品(没卖过)
(1)通过合成或者半合成的方法制得的原料药及其制剂;
(2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂;
(3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂;
(4)由已上市销售的多组份药物制备为较少组份的药物;
(5)新的复方制剂;
(6)已在国内上市销售的制剂增加国内外均未批准的新适应症。
2.改变给药途径且尚未在国内外上市销售的制剂(途径没卖过)
3.已在国外上市销售但尚未在国内上市销售的药品(首仿)
(1)已在国外上市销售的制剂及其原料药,和/或改变该制剂的剂型,但不改变给药途径的制剂;
(2)已在国外上市销售的复方制剂,和/或改变该制剂的剂型,但不改变给药途径的制剂;
(3)改变给药途径并已在国外上市销售的制剂;
(4)国内上市销售的制剂增加已在国外批准的新适应症。
4.改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂(改盐)
5.改变国内已上市销售药品的剂型,但不改变给药途径的制剂(改剂型/换马甲)
6.已有国家药品标准的原料药或者制剂(已有标准/跟仿)
二、中药、天然药物注册分类
1.未在国内上市销售的从植物、动物、矿物等物质中提取的有效成份及其制剂。
2.新发现的药材及其制剂。
3.新的中药材代用品。
4.药材新的药用部位及其制剂。
5.未在国内上市销售的从植物、动物、矿物等物质中提取的有效部位及其制剂。
6.未在国内上市销售的中药、天然药物复方制剂。
7.改变国内已上市销售中药、天然药物给药途径的制剂。
8.改变国内已上市销售中药、天然药物剂型的制剂。
9.仿制药。
三、生物制品注册分类
第一部分 治疗用生物制品
1.未在国内外上市销售的生物制品。
2.单克隆抗体。
3.基因治疗、体细胞治疗及其制品。
4.变态反应原制品。
5.由人的、动物的组织或者体液提取的,或者通过发酵制备的具有生物活性的多组份制品。
6.由已上市销售生物制品组成新的复方制品。
7.已在国外上市销售但尚未在国内上市销售的生物制品。
8.含未经批准菌种制备的微生态制品。
9.与已上市销售制品结构不完全相同且国内外均未上市销售的制品(包括氨基酸位点突变、缺失,因表达系统不同而产生、消除或者改变翻译后修饰,对产物进行化学修饰等)。
10.与已上市销售制品制备方法不同的制品(例如采用不同表达体系、宿主细胞等)。
11.首次采用DNA重组技术制备的制品(例如以重组技术替代合成技术、生物组织提取或者发酵技术等)。
12.国内外尚未上市销售的由非注射途径改为注射途径给药,或者由局部用药改为全身给药的制品。
13.改变已上市销售制品的剂型但不改变给药途径的生物制品。
14.改变给药途径的生物制品(不包括上述12项)。
15.已有国家药品标准的生物制品。
第二部分 预防用生物制品
1.未在国内外上市销售的疫苗。
2.DNA疫苗。
3.已上市销售疫苗变更新的佐剂,偶合疫苗变更新的载体。
4.由非纯化或全细胞(细菌、病毒等)疫苗改为纯化或者组份疫苗。
5.采用未经国内批准的菌毒种生产的疫苗(流感疫苗、钩端螺旋体疫苗等除外)。
6.已在国外上市销售但未在国内上市销售的疫苗。
7.采用国内已上市销售的疫苗制备的结合疫苗或者联合疫苗。
8.与已上市销售疫苗保护性抗原谱不同的重组疫苗。
9.更换其他已批准表达体系或者已批准细胞基质生产的疫苗;采用新工艺制备并且实验室研究资料证明产品安全性和有效性明显提高的疫苗。
10.改变灭活剂(方法)或者脱毒剂(方法)的疫苗。
11.改变给药途径的疫苗。
12.改变国内已上市销售疫苗的剂型,但不改变给药途径的疫苗。
13.改变免疫剂量或者免疫程序的疫苗。
14.扩大使用人群(增加年龄组)的疫苗。
15.已有国家药品标准的疫苗。
注:
05版(局令第17号)分类与07版基本相同
02版中有单独的“中药注射剂”分类,现在称为“原7类”,其中有些有效部位的中药注射剂相当于现在的5类
02年之前的版本中有“二类”,相当于现在的5类
 爱华网
爱华网