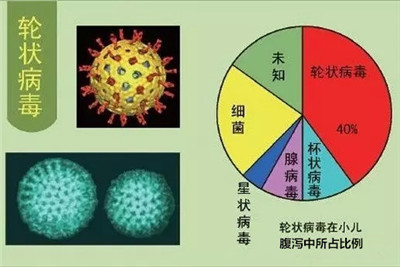
轮状病毒能引起严重的胃肠道疾病,尤其是在5周龄以下儿童和其他年轻的哺乳动物特别容易患病。每年轮状病毒能引起近1.11亿的小孩患上肠胃炎,这使得2500万人到诊所就诊,200万人住院治疗,导致352000到592000人死亡人数。在全球范围内,几乎每个小孩到5岁的时候都有过轮状病毒胃肠炎的经历,每5个中有1人得去诊所,65个中有一人需住院治疗,每293个中有一人死亡。在最贫困地区的小孩患轮状病毒后致死人数达到82%。这种疾病负担急切需要疫苗等进行干预。现已有一种疫苗被开发和认可,但出现了疫苗相关的负面事件,该疫苗使用的申请被驳回。此外关于轮状病毒感染的分子生物学,免疫学和发病机理的信息将不断推动该疫苗开发。
相对于其他几种病原菌来说,我们对于轮状病毒导致的腹泻病的认识是不完面。轮状病毒腹泻被归因于几种不同的病理机制所致,包括肠道上皮细胞的损伤,其次是吸收不良,病毒编码毒素、肠神经系统(ENS)刺激,微绒毛局部缺血。在过去数年之中,许多研究已发展到了分子和组织水平上的腹泻引发机制,且对机制逐渐开始有了新的认识。在此,我将简要地阐述最新研究并提出我们对轮状病毒如何引起宿主腹泻的见解。
最近的研究证实零星的病例报道显示轮状病毒感染不局限于通常认为的肠道感染。轮状病毒感染引起的全身性感染症很少,但相关报道还是陆续发表。最近动物模型的试验已开始,研究病毒如何传播到肠外位点。目前我们对肠外扩散和感染的见解也将在下面讨论。
1 人和动物轮状病毒感染及相关疾病的一般特征
1.1轮状病毒
轮状病毒是呼肠孤病毒科中的一类。轮状病毒是一个无包膜,由复杂的三层衣壳结构组成,该结构围绕由11个片段的双股RNA构成的基因组。轮状病毒有六种结构蛋白和六种非结构蛋白,除了非结构蛋白5和6(NSP5和NSP6)外每一种有相应的基因片段编码,而NSP5和NSP6由单独的片段中重叠的读码框架里编码。轮状病毒属分为A至E血清组。A组到C组感染人类,而所有血清型的轮状病毒感染动物。这里介绍的所有信息是关于A组病毒的感染。
1.2轮状病毒的病理生理学
小肠内层的上皮细胞通常分为两种:肠上皮细胞和隐窝细胞。肠绒毛上皮细胞为成熟的、不增生细胞,并且覆盖了区分了消化和吸收功能的绒毛部位。吸收性肠上皮细胞在顶端表面表达并合成双糖酶,肽酶,和其他酶,这些酶类在顶端发挥其消化功能。吸收通过上皮细胞是由溶质的电化学或渗透性梯度的被动扩散和主动运输两种途径完成。大多数水是通过渗透梯度被动运输,且转运蛋白如钠-葡萄糖协同转运蛋白1(SGLT1)将溶质与水一同转运。隐窝上皮细胞并列排成一列,是绒毛上皮细胞起源。隐窝细胞缺乏定向明确的微绒毛以及肠上皮细胞的吸收功能,但是能分泌氯离子到肠腔中。在一般的动物中,肠上皮细胞与隐窝细胞相结合的活性形成了电解质和水通过上皮细胞的恒定双向流动。在绒毛上,平衡偏向于吸收,在隐窝上,平衡偏向于分泌。
我们对轮状病毒的病理生理方面的认识主要来自动物模型。轮状病毒在不发生细胞分裂的位于绒毛顶端成熟肠上皮细胞复制,而已分化的肠上皮细胞要表达相关的因子需要有效感染和复制。轮状病毒肠道感染的严重程度和定位在各种动物种属和研究中有所不同;不过,这种病理变化仅限于小肠。在不同的动物模型中,轮状病毒感染实际上与不明显的病变,轻微的病变,如肠上皮细胞空泡化和损伤;或者是更大的变化,如绒毛变短以及隐窝增生有关系。相对于其他的肠道病原菌炎症通常是轻微的症状。病理照片显示在组织学损害和疾病症状上没有绝对的关联性。
轮状病毒感染改变了小肠上皮细胞的功能,导致腹泻。腹泻通常认为是吸收不良引起的,其次就是肠上皮细胞损伤。除了肠上皮细胞的损伤之外,当粘膜环腺苷酸没有被改变时,钠离子、水以及粘膜二糖酶的吸收都有所减少。吸收不良导致未经消化的单糖和双糖,糖类,脂肪以及蛋白质直接转运到结肠部位。而未消化的食物具有渗透活性,结肠不能吸收充足的水,导致渗透性腹泻。另外有研究显示腹泻是因为吸收不良,并且是由绒毛局部缺血所致的肠上皮细胞损坏引起。腹泻的分泌物组成受前列腺素E2(PGE2)在被感染肠道的提高得水平和通过PGE2刺激分泌的影响。事实上,肠道病变往往与腹泻的发生无关,这也刺激了对发生腹泻的其他机制的探索。病毒性的非结构蛋白(NSP4),NSP4的分泌片段,或某些NSP4的多肽类发现有毒素样活性并能导致注射小鼠发生腹泻。在,NSP4肠毒素的活性使未明显损伤的肠道引起腹泻性变化,或者引起未感染部位的变化。最近,有报道说阻断ENS活性的几种药物能使肠道中轮状病毒诱导的分泌物的活减少,这也提示ENS在轮状病毒腹泻上的作用。据估计,在小鼠轮状病毒腹泻试验中67%的液体和电解液分泌物是由ENS的激活的。因此,现已清楚轮状病毒腹泻是多因子导致的,是由病毒感染的直接效应以及感染和宿主反应的间接效应导致的。
有些轮状病毒感染是无症状的,这表明病毒和宿主因素可以影响疾病的严重程度。有关病毒因素如下:(1)VP4的一些等位基因可能与无症状的疾病有关。(2)病毒株能被减弱,特别是通过细胞培养时。病毒的衰减通常使得其在宿主体内的复制和引起疾病的能力受限。(3)病毒株似乎能适应在某些特殊种类的宿主中增长。多种宿主因素已显示能影响轮状病毒病的严重程度,包含如下:(1)营养失调被证明能增强轮状病毒腹泻的程度,其延长了小肠的修复且改变肠道的炎症反应。(2)轮状病毒感染普遍受年龄限制。当病毒与NSP4受体在成年动物体内表达时,年龄依赖性似乎与受体表达无关。不过,NSP4受体的信号传导似乎具有年龄依赖性,但是年龄限制可能与免疫相关,随着年龄增加和病毒的显露,中和抗体也随着增加。(3)轮状病毒病可能与年龄依赖性蛋白酶的表达有关,因为病毒传染性需要VP4蛋白酶的分裂且新生动物肠道中蛋白酶保持较低水平。(4)肠道粘蛋白的表达和上皮细胞更新程度以及液体吸收都与年龄相关并证明能影响宿主体内的轮状病毒感染和疾病。
2 当前轮状病毒腹泻的模型
轮状病毒腹泻大部分作用如图1所示。尽管在人类研究中某些方面也有证实,描绘这幅图需要的许多数据是源于动物模型和细胞培养系统。许多最近的评论了关于腹泻的具体方面。从以上的评论和讨论得知,许多病毒和宿主因素可能影响轮状病毒感染和疾病产生。以下是我们集合的轮状病毒腹泻影响因素的相互作用的认识。
轮状病毒结合并侵染到小肠上皮细胞是导致腹泻的开始阶段。病毒的结合是由唾液酸和非甲烷硅基化的受体分子通过一系列的连续作用调节的。该病毒是由一种未知机制内在化,且外在衣壳丢失后,这样就激活了病毒体结合转录酶和病毒大分子复合物。病毒蛋白及RNA在细胞质结构的病毒质中浓缩,此处是RNA合成和包装发生的地方。细胞内物质,很可能包括NSP4,引起了钙离子从内质网的释放。胞内钙离子浓度增加引发了许多细胞过程,包括微绒毛细胞骨架网络的损坏,降低了顶端二糖酶和其他酶的表达,抑制了钠离子协同转运系统以及坏死。NSP4似乎在细胞溶解前被依赖钙离子的非典型的分泌方式所释放。这些物质通过减少上皮细胞的吸收能力,降低了钠离子溶质的协同转运活性,减少了在上皮表面上消化酶的表达引起了吸收不良的腹泻。
被感染细胞中NSP4的释放让未感染细胞发生旁分泌效应。NSP4通过特别的,未经确认的受体而结合到这些细胞上,并引发磷脂酶C-肌糖1,3,5-三磷酸(PLC-IP3)串联效应,该途径以钙离子从内质网中的释放而结束。如果NSP4作用于肠上皮细胞,结果之一就是紧密接头的损坏,导致细胞旁渗透。如果NSP4作用于隐窝,结果将导致钙离子增加,被氯离子转运蛋白调节的隐窝的分泌,导致腹泻的分泌组件增多。感染细胞分泌的NSP4或其他的效应分子也可能刺激ENS。事实上,药剂试验阻断了ENS的功能显示通过ENS刺激轮状病毒感染能引起分泌效应。这些信息阐明相当少的细胞被感染,会对粘膜引起极轻微的损伤,但同样能引起腹泻反应。
3 诱发腹泻的分子基础
轮状病毒腹泻是多因素导致的,有吸收不良和分泌,且可能还有局部缺血和肠的运动性部分。在此我提出了对每一个部分引发的相关数据(相关文献已作筛选以论证观点)。
3.1吸收不良
轮状病毒腹泻吸收不良似乎与最初病毒感染有关。绒毛上皮细胞的感染导致了包括钙离子的一些物质的级联。钙离子体内平衡的这种破坏似乎是通过病毒蛋白来调节的。钙离子渗透性在质膜和内质网的增加导致钙离子的增加,引起一连串反应导致细胞溶解。NSP4在细胞中的表达事实上也能导致钙离子的增加,暗示它是作为病毒诱导钙离子调节异常的介质。NSP4的一个片段(氨基酸112-175)是在感染后的早期通过非典型的路径分泌的,且该片段在胞外的增加也能导致钙离子的增加。钙离子的增加是由NSP4结合到特异的顶端受体上,从而引起PLC-IP3的串联反应而导致钙离子从细胞内贮存中释放出来。然后相反的是,由细胞内NSP4引起的钙离子浓度的增加是与PLC刺激无关的。NSP4介质的效用可能在没有明显组织损坏情况下有放大感染下痢原性大肠杆菌的作用。不过,未激活的轮状病毒微粒导致腹泻的能力暗示了病毒结构蛋白可能在调节异常导致腹泻中发挥着角色。
轮状病毒感染对于肠上皮细胞有其他方面的作用,这可能促成吸收不良。感染导致钠离子增加和钾离子减少,这可能与质膜渗透性增加以及未抑制钠钾离子泵有关。细胞内钠离子和钾离子水平的改变可能损害电中性氯化钠的吸收以及钠离子相关营养物质吸收,导致了液体的减少。钠离子调节异常可能与钠离子协同转运系统的抑制有关。NSP4可能也包含在内,这是因为NSP4114-135缩氨酸是一个特殊的且非竞争性的SGLT1抑制剂。感染在感染的肠上皮细胞表面也能减少消化酶的表达。例如,碱性磷酸酶、乳糖酶、蔗糖酶和麦芽糖酶的活性在减少。蔗糖酶和异麦芽糖酶在人工培养的人肠上皮细胞也在减少,这很可能是扰乱了蛋白目标锁定以及微绒毛的细胞支架。轮状病毒感染通过很多方式改变了极化细胞的结构。尽管其他的细胞骨架蛋白(细胞角蛋白-18)重排与钙离子改变无关,轮状病毒感染引起钙离子增加影响钙离子敏感蛋白F-肌动蛋白、绒毛蛋白、微管蛋白损坏了微绒毛细胞骨架。轮状病毒感染和NSP4促进了紧密连接部位的功能改变促进肠上皮细胞维持障碍。由病毒或NSP4诱导的跨上皮细胞膜电阻提示可能引起旁细胞分泌。轮状病毒也能导致肠上皮细胞分泌CXC和CC趋化因子,提示肠上皮细胞趋化因子分泌物在引导感染的免疫方面有一定作用。白介素-8,GRO-α,趋化因子,干扰素刺激蛋白10,以及粒细胞巨噬细胞菌落刺激因子(GM-CSF),然而其他的趋化因子(肿瘤坏死因子α,IL-1α,IFN-α,IFN-γ,MIP-α,MCP-1和IL-6)并未改变。白介素8和趋化因子值得注意,因为它们是对肠上皮淋巴球最具潜力的化学诱导物。目前尚不清楚病毒复制对于趋化因子分泌来说是否是必需的。此外,前列腺素E2在被感染肠道中水平增高。趋化因子可能刺激免疫反应而不是直接导致腹泻。因此,轮状病毒感染引起绒毛上皮细胞大量的改变从而导致消化不良。
3.2分泌
轮状病毒导致的的分泌对于病毒诱导绒毛上皮细胞功能性改变是次要的。参与分泌似乎是NSP4和ENS。NSP4准确的角色和靶向是未知的。在肠上皮细胞上,NSP4可能有简单的放大感染效果。不过,NSP4可能也在肠上皮细胞钙离子增加中发挥作用,其可能诱导隐窝的增殖,刺激氯离子分泌,且能够导致水溶液的流出。氯离子分泌物被认为是与隐窝细胞中环磷酸腺苷依赖的氯离子通道无关联,因为CFTR(囊性纤维化跨膜电导调节因子)基因敲除鼠对轮状病毒或NSP4诱导的腹泻敏感。在CFTR基因敲除鼠的轮状病毒腹泻中有关氯离子通道的鉴别仍未明朗。有报道NSP4本身可能形成一个通道或者NSP4激活静止的钙离子通道。有趣的是,这些研究也显示轮状病毒腹泻不是因为NSP4受体的年龄依赖性表达或年龄依赖的钙离子调动而是取决于氯离子渗透性的年龄依赖性。分泌的NSP4的另一种可能目标是ENS,其也是典型的霍乱毒素引起的腹泻的目标。事实上,在绒毛上皮细胞中ENS立刻丰富起来,它能从轮状病毒损坏的上皮细胞中接收刺激信号。尽管ENS的NSP4刺激在试验中还未曾现实出来,现已证实ENS与轮状病毒腹泻有关。运用大量的药理试剂可以阻断ENS的刺激明显降低了跨膜电位差,且在尤斯灌流室里或用轮状病毒感染肠道组织的器官淋浴试验中呈病毒剂量依赖性。在器官淋浴试验中,阻断ENS能够将网分泌变成吸收。在活得感染动物中,反复服用利多卡因能显著阻止流体损失。因此,目前已经清楚在轮状病毒感染过程中,ENS有被激活,且这种激活能够解释在绒毛顶端的感染细胞到底有多少能刺激隐窝细胞分泌电解质和水。虽然已知ENS对许多肠上皮细胞释放的分子有反应,但目前还不清楚NSP4是否能直接刺激ENS。霍乱毒素导致的五羟色胺在绒毛上皮细胞中从肠嗜铬细胞中释放出来,且五羟色胺是ENS的刺激物。这很可能是分泌的NSP4结合到了肠嗜铬细胞,导致五羟色胺释放并刺激ENS。同样的,趋化因子的分泌以及被感染的肠上皮细胞的前列腺素可能刺激ENS。
3.3绒毛局部缺血
尽管感染轮状病毒小鼠的肠道上皮细胞的损坏很轻微,但在一些研究里,发现有绒毛局部缺血现象。腹泻可能起因于病毒引起的一种被感染的上皮细胞释放的一种未知的血管活性物质,引起了局部绒毛缺血,并因此对肠上皮细胞有功能性的损坏作用。不过,绒毛局部缺血在其他动物模型中未被发现过,因此,还没有明显的观察结果。
3.4肠道蠕动
在一些腹泻感染中,肠道蠕动显著加强。轮状病毒感染致肠道通过时间缩短,提示增强了蠕动。ENS通常控制蠕动,但对于影响蠕动的分子刺激物还未知。它可能是以上刺激物中的任何一种。
总结下来,轮状病毒腹泻无疑是一种多因素疾病。在吸收不良和分泌部件都有好的证据存在。这些疾病组件的介质从初级细胞损坏到分泌的小肠毒素缩氨酸以及病毒诱导的ENS的相互作用。
4 轮状病毒的全身性感染
L.M Kraft在其轮状病毒被确定之前用幼鼠流行性腹泻病毒(EDIM)对轮状病毒感染做了一些早期的研究。该项研究中一个重要但被低估的方面是轮状病毒是通过口腔感染在感染鼠体内传播的。在感染后72小时,在肺、肝、脾脏、肾、膀胱、大脑和血液中发现有传染性的EDIM。自从大多数发现了EDIM的组织均是高度含血管(脉管)型的组织以来,通常假设病毒是存在于组织中的血液里的。
因此,许多的临床病案报告显示在感染后很多轮状病毒能在肠道外部被发现。目前尚不清楚病毒是否能在这些地方复制和感染或被动的存在于血液里或是由于样品收集过程中的污染导致。包括肝脏中发现病毒的例子伴随着致命的疾病。发现病毒感染伴随着肝酶活性的提高。并证明病毒在免疫缺陷的小孩的肝脏和肾脏中复制。尽管C组轮状病毒中有最好的数据,但提示轮状病毒可引起胆汁不通。有关几个孩子神经病学的报道有伴发的抽搐和轮状病毒腹泻。无论假定的中枢神经系统感染是否源于污染还未可知,不过一项研究已很好的证明了中枢神经系统的感染。在最近的研究中,轮状病毒的抗体在意外死亡的病人心肌中被检测出来,且体外实验证实轮状病毒在初级胰岛细胞中复制的能力,有人发现感染的临时关联与胰岛自身抗体发展有联系。尽管必须考虑到传染的病毒不是独立的且复制只有一次,但这些报道还是很有力的证明了轮状病毒感染很少有全身后遗症。
在动物模型中,轮状病毒也已被证明在经口感染后传播跨越了肠道。在老鼠模型中,传播部位包括固有层、Peyer氏斑、肠系膜淋巴结、肺、肝脏、肾和胆管。A组的轮状病毒已证实导致了小鼠胆汁淤积,但这种系统需要腹膜内的而非经口的途径接种病毒。有关小鼠肠道外传播最详细的研究检查出传播到肝脏需要经过口部接种。
4.1肝脏是全身感染的一个部位
在持续感染SCID的有弥漫性肝炎的小鼠试验中显示了病毒经口感染后在小鼠中的传播途径。感染的病毒从肝脏中分离出来,且存活的小鼠发展出了慢性肝脏疾病。尽管肝炎相对来说没有那么严重且能自然恢复,然而感染病毒仍在普通小鼠的肝脏中被发现到。病毒在肝脏中的传播以及肝炎的发展倍认为有病毒株依赖性。人工培养的人类肝癌细胞(HepG2细胞)的研究支持了这一结果,而在HepG2细胞中一些病毒可能有完全的感染周期而其他病毒不能。特别的病毒株能力感染了从病毒基因组片段4中分离出来的HepG2细胞,编码外衣壳长钉蛋白质VP4。随后的研究表明,在HepG2细胞中无法复制的病毒进入效率较低,但感染的完全阻断发生在细胞内复制周期的晚期(S. Jafar and R. F. Ramig)。
最近的研究利用在肠外蔓延到肝脏的病毒株的差异而作为一种遗传方法以区分传播表型的病毒的决定因素。哺乳鼠经口接种从病毒株RRV(能传播)和SA11-C1(不能传播)收集的重配复合物,在肝脏中侵染的病毒被用于作为一种肠外扩散的替代物。数据的统计分析表明,基因组的7段,编码非结构蛋白NSP3,显然与病毒扩散到肝脏有联系。然而,在肠道中病毒复制至高浓度与其传播的能力无显著相关的。因此,病毒必须通过复制而扩散,不过病毒扩散至肝脏不需要复制至高滴度。一项后续研究显示,病毒通过淋巴管逃离肠道,随后到Peyer氏斑点中,再通过肠系淋巴结,最终到外围组织。这些研究也显示基因组片段6,编码VP6,是次要的传播决定因素。扩散病毒上片段6和片段7的结合物使其能逃离肠道,但这仅仅限于肠系淋巴结而非其他的。NSP3结合一种非结构蛋白使病毒从肠道逃脱暗示病毒在感染细胞间移动。事实上,初始试验表明病毒在肠系淋巴结中被一些肠系淋巴细胞或髓样谱系内在化了(E.C.Mossel和R. F. Ramig, 未公开数据)。NSP3被认为是一种通过结合到非聚信使核糖核酸病毒的信使RNA的3 ,端结合并与引起翻译的复合物相互作用从而在感染细胞中进行病毒的蛋白质合成而规范蛋白质合成的蛋白质。至于NSP3如何作为传播至肝脏的决定因素还不明了。
4.2轮状病毒传播的病毒血症的可能作用和发病机理
关于轮状病毒全身位点的许多临床报告以及小鼠试验显示全身扩散促进了在小孩和动物模型系统中广泛存在的轮状病毒血症的系统研究的证据。在一项回顾性研究中,轮状病毒感染小孩中有66%(22/33)的血清样本通过酶免疫分析(EIA)出轮状病毒抗原阳性,而35位轮状病毒阴性的小孩其血清样本里无抗原。在六个小孩的急性和恢复期血清中,病毒抗原存在于急性而在恢复期血清中没有,这表明抗原血液是短暂的。6个轮状病毒感染小孩的血清样本中仅有3个通过PCR分析呈阳性,这说明通过PCRF方法分析其更低的阳性率反映更低的敏感度。在另一项的研究中,三位死于轮状病毒的小孩被反复检查。在肠道外组织中,三位小孩里有两位通过反转录PCR检测到在肠道外组织(脾脏、心脏、肺、肾脏、睾丸、膀胱、肾上腺和胰腺)中有轮状病毒的RNA。用特别血清型探针杂交的阳性PCR产物的确证表明两小孩感染的肠道外轮状病毒有不同的G血清型。这些发现显示病毒抗原和/或病毒微粒进入到了循环中。
动物模型的前瞻性研究证实人类抗原血以及证明有病毒血症。轮状病毒抗原能通过EIA从试验中感染的婴儿和成年小鼠、大鼠、兔子、小牛血清中100%被检测出来。3只感染的幼鼠用血清做口部接种后血清样本里面有3只产生出了有感染力的病毒,在同样的试验中11只成年鼠里有9只产生了感染病毒。随后对感染了不同病毒株(恒河猴RRV和人HAL1166)的幼鼠做了研究(S. E. Crawford, D. G. Patel, E. Cheng, Z. Berkova,J. M. Hyser, A. A. McKinstry, and M. K. Estes, Abstr. 关于双股RNA病毒的第八届国际讨论会,摘要. W6.4, 2003).。在这些研究中,贡献的动物被灌注缓冲液以清洗周身的组织。轮状病毒抗原在一些灌注动物的小肠、胃、肝脏、肾脏和脾脏中有检测到,提示病毒的存在很可能与这些组织有联系且不是被动的存在于循环里。通过在MA104细胞上的荧光焦点试验能够100%的检出小鼠血清中的感染病毒,这是在当效价达到103病灶形成单位/毫升时(克劳福德等. 关于双股RNA病毒的第八届国际讨论会)。最后,在对于猪的研究中,在感染了衰减的人轮状病毒Wa的无菌小猪中未检测到病毒血症,但在剧毒的人轮状病毒Wa的无菌小猪中能100%的检测到病毒血症。用病毒血症血清额外接种的无菌小猪且观察到腹泻证实了感染病毒存在于血清中(L.J. Saif, M. S. P. Azevedo, L.Yuan, K. I. Nguyen, S. M. Pouly, and M. Gochnauer, Abstr. 关于双股RNA病毒的第八届国际讨论会,摘要. W6.3, 2003)。有趣的是在轮状病毒从肠道移行至肝脏的研究中病毒血症通常不能被观察到。在这些研究中,在60个感染了RRV病毒株的动物里面仅有2个的血液检测出了感染病毒,该种病毒株能诱导100%的小鼠发生抗原血症和100%的大鼠发生病毒血症(克劳福德等. 关于双股RNA病毒的第八届国际讨论会)。尽管这可能表明病毒从肠道移到肝脏通过一种不包含病毒血症的机制,但这种差异的原因目前还不清楚。
此处的结果表明抗原血症在小孩和动物模型中几乎普遍存在。在动物中,由于感染病毒在所有测试动物中存在于血清中,抗原血伴随有短暂的病毒血症。目前小孩的病毒血症还没有被证实是因为血清中缺乏传染病毒的证明,但似乎病毒血症也发生在小孩身上。在轮状病毒感染期间,病毒血症可能为接种外围组织提供了一种机制且可能解释轮状病毒感染与全身性后遗症的联系。不过,这些数据也暗示了对于病毒血症的全身后遗症很少,因为,比如说100%的小鼠和大鼠有病毒血症(4;克劳福德等,关于双股RNA病毒的第八届国际讨论会),但在经口感染了相同的病毒株后仅有25%的小鼠出现了肝脏感染。
5 结尾评论
轮状病毒能自然感染肠道并在对小孩和幼龄动物中造成腹泻疾病。轮状病毒的病理生理学明显是多因素的。腹泻中吸收不良的组件似乎与病毒侵染肠道上皮细胞和分泌的病毒性肠毒素(NSP4)造成的损坏有关。在上皮细胞中看到的效果能够被跟踪主要是由于在上皮细胞钙离子的调节异常所致。轮状病毒腹泻的分泌部分似乎是由于ENS的刺激。ENS的激活模式还不清楚,但它可能通过从感染的上皮细胞分泌NSP4或释放趋化因子和其他因子。腹泻的分泌部分可能是由于分泌型隐窝细胞的钙离子调节异常。我们已经探究了轮状病毒腹泻病成分的分子生物学相关,但在轮状病毒腹泻引发被完全弄清前仍有大量的工作需要深入。
在过去的几年中,对于轮状病毒扩散到肠道外组织的研究兴趣已经被再度点燃。似乎这些中的一部分扩散依赖于病毒因素,但是扩散的其他部分可能与病毒血症的宿主有关。病毒血症与腹泻病在任何方面有无联系目前仍不清楚。对于轮状病毒的全身性感染是否在临床综合症上负责或起作用很重要,目前临床综合症与轮状病毒无关。
本研究在此评论指出我们已在轮状病毒肠道发病机理和扩散到外周组织的分子基础的认识上都有了长足的进步。然而,目前仍有大量的疑问需要被解答。例如,我们需要知道NSP4是否是关键的病毒蛋白或者是否其他病毒结构和/或非结构蛋白在腹泻的发生上发挥作用。NSP4细胞如何能在早期感染中从被感染细胞分泌?ENS是如何被轮状病毒感染激活的,感染细胞释放的NSP4、趋化因子和其他刺激性的分子又发挥着怎样的作用?有多态性NSP4的轮状病毒株在激活ENS上是否不同?年龄依赖性以及感染后激活的钙离子调控的氯离子通道的本质是什么?宿主的先天和适应性免疫反应在肠道疾病或全身性扩散的发展中发挥作用吗?在病毒从肠道扩散至肝脏过程中,对已知的病毒非结构蛋白调节翻译是怎样发挥重要作用的?病毒是怎样接近循环的,以及它在全身位点上能使循环引起重要的临床感染吗?最后,对于决定病毒血症和/或全身性蔓延对普遍的无肠道外后遗症的轮状病毒感染是否有促进作用将显得尤为重要。非常期望以上和其他问题能得到解决,这将增进我们对幼龄时期普遍存在的疾病的理解。
杨帆译
文章源自 JOURNAL OF VIROLOGY
 爱华网
爱华网