含糖的蛋白质,由寡糖链与肽链中的一定氨基酸残基以糖苷键共价连接而成。其主要生物学功能为细胞或分子的生物识别,如卵子受精时精子需识别卵子细胞膜上相应的糖蛋白。受体蛋白、肿瘤细胞表面抗原等亦均属糖蛋白。
糖蛋白普遍存在于动物、植物及微生物中,种类繁多,功能广泛。可按存在方式分为三类:①可溶性糖蛋白,存在于细胞内液、各种体液及腔道腺体分泌的粘液中。血浆蛋白除白蛋白外皆为糖蛋白。可溶性糖蛋白包括酶(如核酸酶类、蛋白酶类、糖苷酶类)、肽类激素(如绒毛膜促性腺激素、促黄体激素、促甲状腺素、促红细胞生成素)、抗体、补体、以及某些生长因子、干扰素、抑素、凝集素及毒素等。②膜结合糖蛋白,其肽链由疏水肽段及亲水肽段组成。疏水肽段可为一至数个,并通过疏水相互作用嵌入膜脂双层中。亲水肽段暴露于膜外。糖链连接在亲水肽段并有严格的方向性。在质膜表面糖链一律朝外;在细胞内膜一般朝腔面。膜结合糖蛋白包括酶、受体、凝集素及运载蛋白等。此类糖蛋白常参与细胞识别,并可作为特定细胞或细胞在特定阶段的表面标志或表面抗原。③结构糖蛋白,为细胞外基质中的不溶性大分子糖蛋白,如胶原及各种非胶原糖蛋白(纤粘连蛋白、层粘连蛋白等)。它们的功能不仅仅是作为细胞外基质的结构成分起支持、连接及缓冲作用,更重要的是参与细胞的识别、粘着及迁移,并调控细胞的增殖及分化。
寡糖链通常指由2~10个单糖基借糖苷键连成的聚合体。糖蛋白的寡糖链多有分枝。由于单糖的端基碳(异头碳)原子有α、β两种构型,而且单糖分子中存在多个可形成糖苷键的羟基,因此,糖链结构的多样性超过多核苷酸及肽链。在糖链结构中可以贮存足够的识别信息,从而在分子识别及细胞识别中起决定性作用。糖蛋白参与的生理功能包括凝血、免疫、分泌、内吞、物质转运、信息传递、神经传导、生长及分化的调节、细胞迁移、细胞归巢、创伤修复及再生等。糖蛋白的糖链还参与维持其肽链处于有生物活性的天然构象及稳定肽链结构,并赋予整个糖蛋白分子以特定的理化性质(如润滑性、粘弹性、抗热失活、抗蛋白酶水解及抗冻性等)。
糖蛋白与很多疾病如感染、肿瘤、心血管病、肝病、肾病、糖尿病以及某些遗传性疾病等的发生、发展有关。再者,细胞表面的糖蛋白及糖脂可“脱落”到周围环境或进入血循环,它们可以作为异常的标志为临床诊断提供信息;患某些疾病时体液中的糖蛋白亦常有特异性或强或弱的改变,这可有助于诊断或预后的判断。糖蛋白还日益介入治疗。例如,针对特定细胞表面特异性糖结构的抗体可作为导向治疗药物的定向载体。利用糖类(单糖、寡糖或糖肽)抗感染及抗肿瘤转移也已崭露头角。
生物合成及降解 糖蛋白的生物合成就蛋白质部分而言与一般分泌蛋白质相同,在粗面内质网进行。糖链的生物合成在肽链延长的同时和(或)以后进行。始于粗面内质网,经滑面内质网,完成于戈尔吉氏体,有的甚至在到达质膜后在那里最终完成。肽链的糖基化及糖链的延长都在各种糖基转移酶的催化下进行。糖基转移酶有两个作用物。一个是活化形式的单糖,作为糖基的供体,另一个是肽链或寡糖链,作为糖基的接受体。糖基转移酶对供体及接受体皆有严格的特异性。一种糖苷键由一种酶催化形成。糖链的结构及糖基排列顺序无模板可循,而是由糖基转移酶的特异性(包括单糖基种类、端基碳构型、糖苷键连接位置及接受体结构)及其作用的先后顺序决定,因此是由基因通过糖基转移酶而间接控制的,属于基因的次级产物。
糖蛋白的降解可从糖链开始,亦可从肽链开始,糖蛋白肽链的降解同样是在各种蛋白水解酶的催化下进行的。糖链的水解由各种糖苷酶催化。糖苷酶分为外切及内切糖苷酸两大类。外切糖苷酶水解糖链非还原末端的糖苷键,每次水解下一个单糖。这类糖苷酶主要存在于溶酶体中,参与糖蛋白、糖脂及蛋白聚糖的分解代谢。糖苷酶对于所水解的糖苷键及作用物的糖结构(有的不仅要求一定的单糖,还要求一定的糖链结构)具有严格的特异性。一条糖链的完全水解是在一系列糖苷酶依次作用下完成的,每种糖苷酶只能水解下来一个特定的单糖。如果缺少一种糖苷酶,则下一步的糖苷水解被阻断,导致糖链水解不完全,而致分解代谢中间产物在细胞内堆积成为糖累积症。例如缺乏α-甘露糖苷酶或α-L岩藻糖苷酶可分别引起甘露糖苷或岩藻寡糖、糖肽的堆积。它们多为先天性酶缺失所造成,属于遗传性疾病。血浆糖蛋白的降解在肝中进行,其非还原末端唾液酸基直接控制其清除率。内切糖苷酶可水解糖链中的糖苷键。常作为工具酶用于糖链结构的研究。主要存在于微生物及植物中,动物组织中少见。其特异性十分严格。除糖蛋白外,透明质酸及细菌壁胞壁酸的降解亦由内切糖苷酶(如透明质酸酶及溶菌酶)催化。
生物学作用 生物界种类繁多的糖蛋白执行着千差万别的生物学功能。如作为酶的糖蛋白催化体内的物质代谢;作为免疫分子的糖蛋白参与免疫过程;作为激素的糖蛋白参与体内生理、生物化学活动的调节等等。糖蛋白中糖链的生物学作用是研究的热点,许多问题还未阐明。大致可归纳为直接或间接参加生物学功能两种情况。直接参与生物学功能方面的作用与细胞或分子的生物识别有关;间接作用则在于维持整个分子的天然构象,保持一定的活性寿期及决定理化特性等。
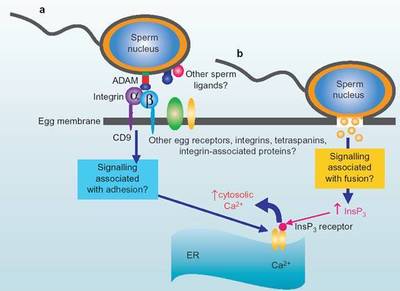
糖蛋白糖链最独特的生物学作用是参与生物识别。细胞识别无论对于个体发生还是成体生命活动的维持都具有决定性意义。例如,同种受精决定于精子表面和卵透明带糖蛋白糖结构的相互识别。细胞表面糖蛋白还参与早期胚胎发育过程中内细胞团及滋养层的形成及随后组织、器官形成过程中同类细胞在识别基础上所发生的聚集。胚胎发育需全能细胞进行分化。通过细胞迁移及生物识别,相同的细胞在一定部位聚集成团,最后发展为特定的器官。这些过程依赖于特异性的细胞识别及选择性的细胞粘合。糖蛋白糖链是细胞识别及粘合的分子依据。在结构多样的糖链中存贮着足够的各种识别信息。抑制糖蛋白糖链的生物合成则胚胎发育中止。在胚胎发育的不同阶段及细胞增殖的不同时相细胞表面糖蛋白不断发生改变。某些细胞表面糖蛋白可以作为不同发育阶段或不同生活状态的标志。例如,神经细胞粘合分子(N-CAM),是一种存在于细胞表面的质膜糖蛋白,其糖链含有多个唾液酸基。多唾液酸链随发育而缩短,至成年时期消失。糖链中唾液酸的这些变化对不同时期细胞间的相互作用有一定调节意义。N-CAM可能在胚胎发育中对细胞间相互作用具有普遍性重要意义,对神经细胞间的突触联系及神经—肌肉连接的建立更具有特殊重要作用。在若干恶性肿瘤细胞表面亦发现具有多唾液酸糖链的N-CAM。
细胞归巢在造血、毁血及淋巴细胞再循环中必不可缺。在血中循环的造血干细胞(来自卵黄囊)需到骨髓中进行增殖、分化;淋巴细胞在血流及淋巴样器官(脾、淋巴结及扁桃体)间保持再循环。血循中造血干细胞及淋巴细胞的归巢都是通过细胞表面的受体(亦属于凝集素)来认别靶组织中糖链上的糖基而进行。衰老红细胞“归巢”入脾是由于其表面的带Ⅲ糖蛋白糖链游离末端的唾液酸基大为减少,导致次末端的半乳糖基暴露。它可与免疫球蛋白G结合,从而可被脾内的吞噬细胞识别并内吞。至于致病微生物感染寄主细胞亦必须首先粘附于靶细胞。微生物与靶细胞间的特异性粘合作用不仅可以解释为感染寄主的选择性,而且已有不少证据表明这种特异性粘合是由糖蛋白糖链介导的。
还有一些粘合分子是细胞外的游离成分,由相互作用的细胞产生或由远处的某些细胞产生,分泌至细胞外并运送至细胞间。这些粘合分子作为桥梁介导细胞间的识别及粘合。如出血时血小板的聚集是由两种细胞外糖蛋白及其在血小板膜上相应的受体糖蛋白介导的识别及粘合。这两种糖蛋白是血浆中的血小板反应蛋白及纤维蛋白原。它们彼此之间亦发生特异性识别及结合,并为其糖结构所介导。
糖链亦参与细胞与细胞外基质的粘着作用。细胞外基质的主要成分都是含糖的蛋白质,如胶原、非胶原糖蛋白及蛋白聚糖等。在各种细胞表面则分别存在着特异性结合一定基质成分的受体糖蛋白。这种结合是有选择性的。例如,上皮细胞与基膜中的Ⅳ型胶原、层粘连蛋白及硫酸乙酰肝素蛋白聚糖结合;成纤维细胞与Ⅰ或Ⅲ型胶原、纤粘连蛋白结合;软骨细胞与Ⅱ型胶原、软骨粘连蛋白及硫酸软骨素蛋白聚糖结合。细胞外基质成分对细胞的增殖、分化、形态、代谢及迁移有决定作用。这对胚胎发育、细胞分化及创伤修复是十分关键的。例如,造血干细胞只有在适于它们增殖及分化的骨髓基质中才能进行造血过程。骨髓的体外长期培养亦必须为其提供相应的造血环境。细胞与细胞外基质之间借助于一定糖结构的结合,在恶性肿瘤细胞的转移过程中亦具有决定性作用。
细胞与其外环境中可溶性糖蛋白(如激素、抑素、干扰素、抗体、生长因子、细胞因子、毒素等等)的作用不但对细胞的增殖、分化、代谢及功能产生深刻影响,而且对维持整个机体内环境的稳定具有重要意义。已有一些实验证明某些可溶性糖蛋白与细胞的作用由糖链介导。糖蛋白激素在去除糖链后,则生物学活性丧失。迄今发现的20种血型体系中的160多种血型抗原完全或主要由糖蛋白及糖脂的寡糖决定。A型、B型及 O型血者的抗原决定簇分别是 α-D-N乙酰氨基半乳糖基、α-D半乳糖基及α-L岩藻糖基。组织相容性抗原亦为糖蛋白。其抗原特异性与糖链结构有关。
糖链与免疫的关系日益受到重视。已发现补体系统可在无特异性抗体存在的情况下被一定的糖链结构活化。不但各种免疫球蛋白都是糖蛋白,其糖链结构对抗原-抗体结合的特异性有一定影响;而且很多免疫介质,如淋巴因子、单核因子、辅助因子、抑制因子、活化因子、趋化因子、毒性因子、干扰素、白细胞介素等及其在免疫细胞表面的受体都是糖蛋白。不少证据表明糖链参与其相互识别和结合。干扰素亦与靶细胞表面的糖结构相结合。
凝集素是广泛存在于动物、植物及微生物中的一类蛋白质,它由非免疫途径产生并特异地与一定糖结构相结合。很多凝集素本身亦为糖蛋白。各种凝集素识别与结合糖结构的特异性强弱不等。一定的凝集素可凝集一定种类的细胞,并可选择性地刺激细胞的有丝分裂。凝集素的上述作用可被特定的单糖或寡糖或糖肽抑制。细胞表面的糖蛋白或糖脂在体外可被一定的外源性凝集素识别并结合,有人称之为凝集素的受体。凝集素即通过其多价性及细胞表面受体而引起细胞凝集。凝集素可存在于体液中及细胞表面。在各种原核细胞及真核细胞生物中发现的凝集素已多达百余种。其生物学功能复杂而多样。但基本作用都是对细胞或游离分子进行识别。例如,在鼠、兔及人的肝细胞质膜中有识别半乳糖的凝集素(肝凝集素)。血浆中的蛋白质多为以唾液酸为非还原末端的N糖苷糖蛋白。去唾液酸后暴露出次末端的半乳糖基,可迅速被肝细胞通过肝凝集素识别而结合,进而引起内吞,从而将去唾液酸血浆糖蛋白摄取,从血中清除并在溶酶体中降解。以致其半寿期缩短至若干分钟。严重肝炎、肝硬变及肝癌的组织中缺乏肝凝集素,从而导致血中去唾液酸糖蛋白的堆积。另外,在肾、肠上皮,甲状腺及骨髓细胞表面亦发现结合半乳糖的凝集素。在肝库普弗氏细胞及脾、肺巨噬细胞表面存在识别和结合甘露糖及乙酰氨基葡萄糖的凝集素。这些细胞表面凝集素一旦与相应配体结合便可引起内吞,内吞后配体在溶酶体中被消化。而凝集素本身可再循环至细胞表面。
糖蛋白糖链对引导在粗面内质网合成的蛋白质到达预定部位有决定性作用。很多分泌蛋白质必须经过糖基化才能分泌到细胞外。若糖基化被阻断则不能分泌出去。溶酶体的各种水解酶在内质网及戈尔吉氏体合成后集中在初级溶酶体内,这亦由其糖链决定。所有各种溶酶体酶,除组织蛋白酶B1外,都是高甘露糖型糖蛋白,其某些甘露糖基发生6位磷酸化。这些带有[6]磷酸甘露糖(Man-6-P)标志的溶酶体酶与定位在戈尔吉氏体膜腔面一定部位的受体相结合。这些受体实际上是特异性识别Man-6-P的凝集素。通过这些集中分布在一定膜区的受体带有M-6-P标志的溶酶体酶被集中起来,再通过该膜区的发泡,从戈尔吉氏体形成膜内面挂着全套溶酶体酶的初级溶酶体。溶酶体膜含有高度糖基化(每条肽链上带10余条糖链)的糖蛋白,其糖链富含唾液酸,并朝向腔面。这些糖蛋白糖链不但可以防止溶酶体膜被溶酶体内的水解酶降解破坏,而且可以在溶酶体腔面形成低pH值环境,使溶酶体酶与膜受体的结合减弱,然后溶酶体酶的糖链发生脱磷酸。由于脱磷酸去除了可被膜受体识别的标志,各种水解酶遂游离于溶酶体囊腔内。当初级溶酶体与内吞泡融合后溶酶体酶即可水解经内吞进入细胞的大分子及细胞、组织碎屑。此外,在细胞表面亦存在特异性识别Man-6-P的受体。可将分泌至细胞外的溶酶体酶结合并内化回收。细胞表面识别Man-6-P的受体只占细胞总受体量的10%,其余90%存在于溶酶体、戈尔吉氏体及内质网。人类罹患的一种稀有病,I-细胞(inclusion-cell)病系在细胞内堆积大量的高分子量糖复合物,可造成早天。其缺陷主要是缺乏UDP-N乙酰氨基葡萄糖基转移酶,因而溶酶体酶缺乏Man-6-P标志。以致其各种溶酶体水解酶不存在于溶酶体内而被分泌至细胞外。其溶酶体膜及细胞表面虽存在正常的识别Man-6-P的受体,却不能将自身的溶酶体酶按正常路线运送。但可将外源性正常的带标志的溶酶体酶回收并运至溶酶体。
植物凝集素常有不同程度的细胞毒性。毒性强的凝集素有蓖麻毒素、相思豆毒素等。它们都识别并结合含半乳糖的糖链。这些毒素由A、B两个亚单位组成。B亚单位与细胞表面的糖基结合,A亚单位进入胞质与核糖核蛋白体结合从而抑制蛋白质生物合成,其作用原理类似于酶的催化作用,催化核蛋白体因子失活。胞质中只需几个分子细胞毒凝集素即可完全阻断蛋白质的合成。因而仅极少量即可置人于死地。将细胞毒凝集素与抗肿瘤细胞的特异性抗体偶联,可定向杀伤体内的肿瘤细胞。
有些糖蛋白的糖链本身并无直接的生物学功能。而可对肽链的加工及其构象施以控制。一些多肽或蛋白质以巨大的前体形式在细胞内合成,然后被特异性蛋白酶水解释出成熟的有生物活性的分子,例如垂体的一些激素是以前体的形式生成的。前体上的糖链可控制其在适当的部位被蛋白酶水解,从而有效地产生生物活性成分。再如,若抑制前胶原的糖链合成,则不能生成胶原。糖链又可以控制肽链的折迭及稳定肽链的天然构象,去除糖链则某一区域的构象改变,影响其生物学活性。如免疫球蛋白G(IgG)去除糖链则与抗原结合的构象改变。此外,糖链还决定糖蛋白分子的理化性质,使其具有:①抗蛋白酶水解性,使糖蛋白分子在体内可维持一定的寿期。蛋白酶的糖链可保护其肽链不被自家水解而保持催化活力。体液中的糖蛋白糖链可保护其不至迅速被体液中的各种蛋白酶水解而在一定的时期内保持其生物活性。很多种生物活性分子,如酶属此类。粘液中的糖蛋白糖链在保护其自身不被水解的同时亦保护了粘膜上皮细胞。②稳定性,不易发生热变性及冻融变性。③抗冻性,南极鱼的抗冻糖蛋白的密集式糖单位可防止冰晶形成而使鱼体在深低温海域不冻结。此外,粘液及滑液中的糖蛋白由于存在大量唾液酸化或硫酸化糖链而带有很多负电荷,以致分子呈伸展状态并具有强亲水性,成为具有粘弹性的物质,起润滑保护作用。糖蛋白分子的聚合能力亦为糖键所左右。
糖蛋白与肿瘤 在肿瘤发生及发展(侵袭、转移)过程中细胞表面、细胞外基质及体液中的糖蛋白都有显著变化;抑制体外培养的癌细胞的糖链合成,即可抑制其在体内的实验性转移。尚未发现为一切肿瘤细胞所共有,而不为正常组织所有的肿瘤共同抗原,但已在不少种肿瘤组织细胞中发现为某种肿瘤所特有而不为相应正常分化组织所具有的肿瘤相关抗原。这些抗原常为在相应正常组织胚胎细胞一时性表达的糖蛋白。例如,癌胚抗原(CEA)是分子量200KDd的糖脂蛋白质含糖50~60%。它存在于正常胎儿胃肠组织及消化道腺癌细胞表面,并可脱落进入血流,从而早期胃肠癌、胰腺癌、乳腺癌患者血中CEA含量即可升高。再如,甲胎蛋白(AFP)为分子量70KDa的糖蛋白。由胚胎的卵黄囊、肝及胃肠合成,是胎儿血中的主要蛋白质;70%的畸胎瘤及肝细胞癌患者血中AFP升高。
肿瘤细胞表面的糖蛋白可整个地或部分地脱落,进入血循环。因此可用于临床诊断及病情监测。这些脱落成分亦可中和寄主血中的抗体,削弱寄主机体的抗肿瘤能力。
 爱华网
爱华网