【按】孔子曾说:传道、授业、解惑,便可以为师,可见回答疑问是教师一件多么重要的工作,教师在教学工作中一定会遇到很多学科专业问题,它们来源于教师自身的专研、同行的交流、学生的请教,教师便在思考解答这些疑问的过程中成长、发展,此所谓“教学相长”,基于此我将平时发表或他人发表的部分疑问解答发在博客中供大家查阅参考!
疑问:教材[1]146页第一自然段第二行:“在常温下,硅的化学性质不活泼,……”;145页第二节第一自然段第二行:“在自然界中,没有游离的硅,只有以化合态存在的硅,……”;既然在常温下,硅的化学性质不活泼,为什么自然界中没有游离态的硅单质?
回答:
基态时,硅的原子电子组态为:Si:[Ne]3s23p2,硅原子价层3s、3p轨道有电子占据,能级相近的3d空轨道可以参加成键作用,因d轨道参加成键,除形成sp3d和sp3d2等杂化轨道外,还使Si—O等类型化学键因pπ-dπ作用而大大增强[2]。
表硅化学键的键长和键能[2]
键 | 键长/pm | 键能/(kJ·mol-1) | 键 | 键长/pm | 键能/(kJ·mol-1) |
Si—Si | 235 | 226 | Si—O | 166 | 452 |
由表1可以看出键能(E)的关系:E(Si—O)>>E(Si—Si)
自然界中硅的主要存在形式硅酸盐,主要是以[SiO4]4-基团组成,在[SiO4]4-基团中,Si除以sp3杂化轨道和4个氧原子按四面体方向形成4个σ键外,Si原子的dx2-y2和O原子的p
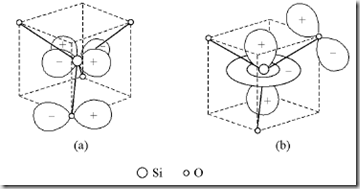
轨道相互叠加,由O原子提供电子成键,如图1(a)所示,同时Si原子的dz2轨道也可和O原子的pπ轨道互相叠加,由O原子提供电子成键,如图1(b)所示。由于这种pπ→dπ的作用,使Si—O键增强,键长缩短,键能增加。在硅酸盐中,Si—O键的平均键长为162pm,它比和的共价单键半径和(113pm+77pm=190pm)短28pm[2]。
图[SiO4]4-中的pπ→dπ配键(每种只示出一个)
(a)pπ→dx2-y2,(b)pπ→dz2,注:引自文献[2]。
在地壳形成时温度很高,且硅与氧具有高亲和力[3],能够生成更为稳定的Si—O四面体结构,因此,丰度仅次于氧的硅单质在自然界中就并不存在了,即自然界中不存在由Si—Si键连接的纯硅单质,而是基本上是以更为稳定的Si—O键结合的硅酸盐的形式存在[2]。
参考文献:
[1]人民教育出版社化学室.全日制普通高级中学教科书(必修)化学第一册[M],北京:人民教育出版社,2003:145-146
[2] 周公度.碳和硅结构化学的比较[J] .大学化学,2005,20(4):1-3
[3] [英]C·A·皮尔斯.华东师范大学化学系翻译组译,硅化学及其应用[M],上海:上海教育出版社, 1984:6
[4]白涛,魏群等.对“硅”教学中几个疑问的探讨[J],化学教学,2008,(3)
 爱华网
爱华网