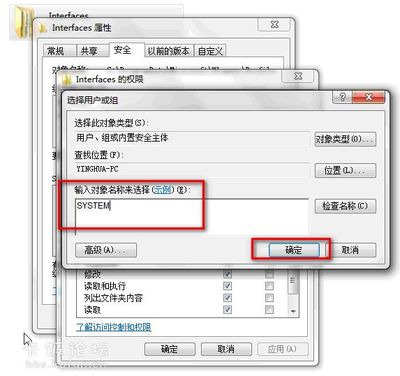
一用EP管离心收集少许菌体(菌体的量无需太多),加入适量的灭菌水重悬,沸水10min,12000rpm离心5min,用上清做模板进行PCR。
二 菌液PCR方法:
1.用小枪头或灭菌牙签调取培养皿上少许细菌,直接加入到PCR反应体系中,涡旋,瞬时离心,再PCR。95度预变性5分钟可使细菌裂解,释放DNA;
2.取1ml菌液置于EP管中,100度水浴5分钟,10000rpm离心1min,取上清1-2ul为模板进行PCR;
3.注意:菌液PCR假阳性率高,建议在做过菌液PCR后,选取阳性菌株提取质粒PCR、酶切。操作过程避免污染。煮菌时菌液最好加1ml(用1.5mlEP管),以免EP管盖在加热过程中爆开,增加污染机会。
三 可以更简单些,菌落PCR方法:
1.用小枪头或灭菌牙签调取培养皿上少许细菌,直接加入到20-30微升水中,混匀,根据需要取适当体积的混匀菌液(2-5微升/15-20微升总体系)作为模板加入PCR反应体系中,95度预变性10分钟进行pcr即可;
2.菌液可直接取适当体积的混匀菌液(1-2微升/15-20微升总体系)作为模板加入PCR反应体系中,95度预变性10分钟进行pcr即可;
非常同意congcizui 的观点,菌液PCR假阳性率高,一定要选取阳性菌株提取质粒PCR、酶切。
四我用过更简单的办法,就是拿摇起的菌液直接作模板,无须经过100度裂解细菌和高速离心,菌液不用处理,直接加入PCR反应体系,20ulPCR体系加1ul菌液即可.
五 1,在摇菌时,挑了克隆后,在37度摇床中摇菌一般不超过14小时即可~~
2,此时即可直接用菌液做PCR,一般20ul的PCR体系中加入2ul的菌液做模板~,也可视其浓度自己摸索一下,浓度很高的话可以适当减少加入的模板量~~
六细菌培养液能直接用于PCR扩增吗?在我的实验中,细菌培养物经基因组提取后能扩增出需要的片段,但用同样的体系和条件未能从菌液中直接扩增出。这是为什么?
1同样的条件是不对的,应该先将菌落100度5分钟裂解后加入TAQ酶再进行PCR扩增。
菌落PCR的假阳性率较高,一定要做好严格的阴性和阳性对照,同是保证酶、buffer等反应体系没有污染,建议还是提取基因组DNA扩增。
2我一直是用菌液做PCR,效果很好,得到的产物非常多,至于易于污染的问题,只要严格操作是可以避免的,同时可多做几个克隆的菌液,如果有的条带很强,有的条带很弱,那么弱的很可能是被污染的,因为一般来讲,污染的体系扩增的产物应该是较少的。
在PCR反应时设置95度预变性5分钟是非常必要的,因为这时可以使细菌裂解,释放出DNA。如果将菌液处理后再PCR,那么在处理过程中会增加污染的机会。
3用菌液行PCR还有一个小窍门,省很多事,就是你在挑菌落进行培养时准备1.5ML的EP管,每个管中加入1ML培养基,用接种针挑取菌落接种于EP管中,摇菌几个小时,摇动EP管观察,如果发现有混浊即可用来PCR。我从一开始就用这一方法,非常成功,省去了准备试管的时间,并且菌液存于有盖的EP管中,用来测序,冻存非常方便。在用接种针接种时很多人担心接种不上,因此反复的挑菌落,其实大可不必,当接种针在来板上无菌落的地方冷确后,轻点菌落一下,然后在EP管中涮一下即可,肯定能接种上。
后来听我们老板说国外实验室在挑细菌克隆时也是用EP管摇菌的,尽管放心的用吧,会成功的。
T-载体自连
1 按理T载体自连是毒性致死的
2对于T载体而言,这很正常啊。一般情况下,大概有20%左右的蓝斑,在剩下的80%的白斑中,也可能存在假阳性的情况。要以酶切的结果为准,如果没有插入片段被切出,即使是白斑也没有用。建议多选几个菌落,对于个连接,至少要有6—8个菌落来筛选,如果都不是就不必找了,重新做克隆吧。
3 求教:用PMD19-Tvector做PCR产物(1000bp左右)的连接,如果载体自连的话(蓝斑)是单个载体的自连还是两个载体的自连,还是两种情况都有,或者有更多的情况?
还有他们的几率哪个较大?
答: 应该是两种情况都有。不过个人感觉T载体自连几率非常小啊
你的模板与载体的摩尔比是多少?---摩尔比是1:1,
TaKaRa的TVector发生自连是肯定的,只是多少的问题,它与我们平时自己的载体是一样的,最近做了1700bp的连接,有的克隆挑了8个才有一个阳性。注意载体与外源基因的比例控制在1:3-1:10之间,这样可以降低自连的几率;1000bp应该还是可以的,一般来说,片段越大,连接成功的几率就会变小,超过3000bp,一般来说T载体就无能为力了;从以前使用的情况看,T载体本身各批次之间的质量是不一样的,有时自连率低,有时买的自连率高。
目标片段过量,连接试试,阳性率应该挺高的,我连接900bp左右,蓝斑只有几个而已。
 爱华网
爱华网