镁跟氯化铁溶液的反应,在一些书刊里对这个反应的化学方程式有如下几种写法: ,,Ⅰ Mg +2Fe(OH)3 (稀溶液) = MgCl2 +2FeCl2
Ⅱ Mg + 2Fe3+ = Mg2+ +2Fe2+
Mg +2H+ =Mg2++H2 ↑
Mg + Fe2+= Mg2+ + Fe
Mg,+2H2O =Mg(OH)2 + H2 ↑
Ⅲ 3Mg +2FeCl3 +6H2O ==3MgCl2 + 2Fe(OH)3↓ +3H2 ↑
笔者通过化学实验和分析,认为上述反应式都不符合实际,1。而应该是:
Ⅳ 4Mg (不足量) + 4FeCl3 + 6H2O =4MgCl2 +2FeCl2 + 2Fe(OH)3↓+3H2 ↑
Ⅴ 6Mg (过量) + 4FeCl3 + 6H2O = 2Fe +6MgCl2+ 2Fe(OH)3↓+3H2 ↑
上面方程式是从下面实验事实得出的:
实验一,在盛氯化铁溶液的试管里加入镁粉,①立即有大量气体生成。点燃时有爆鸣声,
证明有氢气生成。②反应时有红褐色难溶物生成,经检验是氢氧化铁。③在反应时,取反应混和液,加入铁氰化钾溶液,立即有蓝色沉淀生成,证明溶液里有Fe2生成。④当镁粉过量时,待反应进行一段时间后,取试管下面的难溶物经过滤、干燥,用磁铁检验,有铁粉生成。⑤待反应结束后,取此清液,分别加入铁氰化钾和亚铁氰化钾溶液,都没有蓝色沉淀生成。说明当镁粉过量时,反应结束后,生成物里无Fe3+或Fe2+离于。⑥取反应结束后的溶液,加入少量氨水,有白色沉淀生成。再加入浓的氯化铵溶液,白色沉淀溶解。说明生成物里有Mg2+离子。
如果用氯化铁的稀溶液与镁粉反应,或者用除去氧化膜的镁条代替镁粉,现象同上。
通过上述实验可知,足量的镁粉与氯化铁溶液反应的生成物应该是:单质铁、氢气、氢氧化铁和氯化镁。
实验二,在盛氯化铁溶液里加入少量镁粉,开始有氢气和红褐色氢氧化铁沉淀生成。待反应结束后,溶液由橙黄色变和浅黄色并显酸性。反应开始生成的红褐色氢氧化铁沉淀部分溶解。取反应后的混和液,分别加入铁氰化钾和亚铁氰化钾溶液,都有蓝色沉淀生成。由此可知,氯化铁溶液跟不足量的镁粉反应的生成物是氢气,氯化亚铁,氯化镁和氢氧化铁。
实验三,在试管里加入少许镁粉,再加入2—3毫升苯,再加少许氯化铁溶液。苯浮在氯化铁溶液上面,隔绝反应物与空气的接触,避免空气中氧气的干扰。此时立即有大量的气体和红褐色沉淀生成,没有白色沉淀物生成。实验说明,反应生成的氢氧化铁不是由氢氧化亚铁被空气里的氧气所氧化而来的,而是反应的直接产物。
上述实验结果,我的看法是这样的,镁还原性较强,Fe3+具有较强氧化性,同时,Fe3+的水解使溶液呈酸性,而H+也有一定氧化性,查得Ε0值如下:
Mg2+ +2e- MgE0 == --2.375
Fe2+ +2e- FeE0 == --0.409
2H+ +2e- H2E0 == 0.000
Fe3+ + e- Fe2+E0 == 0.770
从标准电极电位可知,镁首先应和Fe3+反应,生成Mg2+和Fe2+,同时镁又与盐水解生成H+的反应,生成H2和Mg2+,由于H+浓度降低,从而促进了Fe3+水解反应,
Fe3+ + 3H2OFe(OH)3 + 3H+
并有红褐色氧氧化铁的沉淀生成。
由于溶液里H+浓度的降低。能否有Fe(OH)2或Mg(OH)2的沉淀生成呢?查得它们Ksp如下:
Fe(OH)3 Ksp ==1.1×10--36
Fe(OH)2 Ksp ==1.64×10--14
Mg (OH)2 Ksp ==1.2×10--11
从难溶电解质在水中的溶度积可知,Fe(OH)3的溶度积最小,又因反应开始时有大量Fe3+
的存在,故立即有Fe(OH)3沉淀生成,难生成Fe(OH)2和Mg(OH)2的沉淀。
随着反应的进行,当镁粉不足时,Fe3+只能被还原成Fe2+,而反应开始生成的Fe(OH)3
沉淀部分溶解在酸性的FeCl3、FeCl2溶液里。如镁粉过量,Mg继续与Fe2+离子反应,生成单质铁析出。
综上所述,·笔者认为镁与氯化铁溶液的反应,应该是:
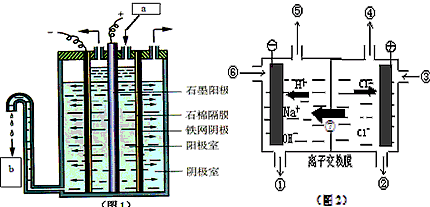
4Mg (不足量) + 4FeCl3 + 6H2O =4MgCl2 +2FeCl2 + 2Fe(OH)3↓+3H2 ↑
6Mg (过量) + 4FeCl3 + 6H2O = 2Fe +6MgCl2+ 2Fe(OH)3↓+3H2 ↑
同时还可认为开头所列的方程式Ⅰ、Ⅱ、Ⅲ都不符合实际。Ⅰ式没有注意到氯化镁溶液的水解。镁能与水反应生成氢气,更何况镁在氯化铁的酸性溶液里,反应就更迅速了。反应式Ⅱ,虽然兼顾了离子的水解,但在生成沉淀上有误解。反应式Ⅲ的主要反应产物是对的,但是忽略了Fe或FeCl2的生成,违背了实验事实。
 爱华网
爱华网