《复分解反应》说课稿
周至七中 席进
一、教材分析
1、本节内容在教材中的地位及作用
复分解反应是继前面学过的多个反应类型后又一种新的反应类型。它涉及的反应多,应用范围广,贯穿对酸、碱、盐学习的始终,在教材中占有很大的比例,所以本节内容在教材中的地位和作用是非常重要的。
2、教学目标
(1)知识目标
掌握复分解反应的定义、条件、写法及本质。
(2)能力目标
通过对复分解反应本质的理解,解决物质、离子共存问题。
(3)情感目标
通过学生活动,小组讨论,归纳总结,练习,培养学生观察、分析、归纳及运用知识的能力。
3、教学重点、难点和关键点
(1)本节重点
本节课的重点是掌握复分解反应的条件、写法,因为复分解反应的条件是判断复分解反应能否发生的依据,是书写复分解反应化学方程式的前提,教材中的化学方程式涉及复分解反应的较多,所以复分解反应的条件及写法理应成为本节重点。
(2)本节难点:
本节难点是对复分解反应本质的理解。原因是复分解反应的本质就是离子的重组,微观抽象,学生难以直观理解。
(3)本节关键点:
本节关键是对难电离物质的理解。
二、教法分析:
本节课我主要采用以下教学方法:
1、导问法:
本节课有几处学生活动环节,在学生活动过程中教师通过提问,引导学生分析思考得出结论。如学习复分解反应的定义、条件、写法过程中都采用此法。
2、归纳法
让学生观察只停留在对知识的表象认识,通过归纳就可以上升为理论,从而得出规律性的知识。本课中多处采用归纳法。
3、讲练结合法
为了突出知识的产生过程,我采用了讲练结合法,通过此法加深了对知识点的理解,巩固了知识点。
三、学法指导
1、讨论法
2、归纳法
3、练习法
四、教学过程
1、复习导入
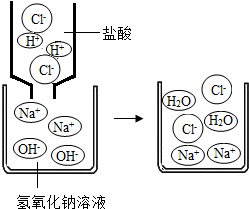
回顾酸碱中和反应,从微观粒子的角度动态展示NaOH和盐酸反应的过程,导出复分解反应。
此导入既复习旧知识,又形象具体的展示物质解离的过程,为学生归纳复分解反应的定义提供了依据,对复分解反应的本质作了铺垫。同时,为复分解反应方程式的写法打下了基础。
2、探究活动
(1)活动1
结合NaOH和盐酸反应的微观过程让学生归纳复分解反应的定义。
(2) 活动2
教师出示一组化学方程式,学生判断是否为复分解反应
①Fe2O3+6HCl=2FeCl3+3H2O
②Cu(OH)2+H2SO4=CuSO4+2H2O
③Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
④Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
⑤NaCl+AgNO3=AgCl↓+NaNO3
⑥CO2+Ca(OH)2=CaCO3↓+H2O
观察以上复分解反应,完成以下表格:
反应类型 | 满足条件 | ||
反应物 | 生成物 | 反应物满足条件 | 生成物满足条件 |
此环节中以学生活动为主,让学生自主发现知识,重视知识产生的过程,突出了学生主体地位,提高了学生的能力。
(3)活动3
教师出示一组物质,让学生判断能否发生复分解反应。如能,试着写出反应的化学方程式。
①Na2CO3+CaCl⑤CuSO4+BaCl2
②KOH+HCl⑥Ba(OH)2+CaCO3
③H2SO4+NaCl⑦BaSO4+ NaNO3
④K2 CO3+HCl⑧Ca(OH)2+H2SO4
此环节巩固复分解反应条件,运用复分解反应的条件来判断物质间是否发生复分解反应,归纳复分解反应的写法。
活动4
教师提问:我们已总结出复分解反应条件,就是有沉淀、气体或水生成,这是什么原因呢?
[动画演示] NaOH和盐酸,AgNO3和NaCl溶液反应的过程并讲解。
此环节设计从微观上展示复分解反应的实质,加深了对复分解反应的理解。
3、应用
多媒体显示习题(见中考精典)
设计意图:能运用复分解反应发生的条件判断复分解反应能否发生,会写出复分解反应的化学方程式,加深对复分解反应的理解,进而解决物质共存,离子共存问题。
4、板书设计
复 分 解 反 应
1、定义:两种化合物互相交换成分,生成另外两种化合物的反应。
2、条件:有沉淀或有气体或有水生成。
3.复分解反应的类型:
4、本质:离子相互反应,生成难电离的物质。
5、复分解反应的应用:
① 生活中的应用
② 学习中的应用
 爱华网
爱华网



