叶绿素荧光动力学曲线和快速叶绿素荧光诱导动力学曲线的异同
姚广
汉莎科学仪器有限公司山东271000
英国Hansatech公司中国总部
电话:0538-8241341传真:0538-8249608网址:www.hanshatech.com电子邮箱:pplab@163.com早在1931年Kautsky和Hirsh就认识到光合原初反应和叶绿素荧光之间有着密切的关系。他们第一次报告了经过暗适应的光合材料照光后,叶绿素荧光先迅速上升到一个最大值,然后逐渐下降,最后达到一个稳定值。此后,随着研究的深入,人们逐步认识到荧光诱导动力学曲线中蕴藏着丰富的信息。
叶绿素荧光动力学曲线:
图1用脉冲调制式荧光仪测定荧光参数的叶绿素荧光动力学曲线
(注:引自许大全著《光合作用效率》2002)
典型的叶绿素荧光动力学曲线是图1作用光后边到第二次饱和脉冲光之前的曲线部分,图1的整条曲线是为了计算所有荧光参数,通过在不同时间开启饱和脉冲光来关闭反应中心获得特殊的荧光参数。从叶绿素荧光动力学曲线我们主要来获得原初光化学反应,以及光合启动后实际光化学效率、光能的吸收利用等。
脉冲调制式荧光仪,无论商家吹嘘可以测定多少荧光参数,而实际上最重要的就是图1中测定的5个基本参数,其他一切参数都是根据这五个基本参数计算出来的。充分暗适应的叶片,在很弱的检测光下,测定得到最小荧光Fo,这时所有反应中心处于开放状态;接着开启饱和脉冲光(0.7s)测得最大荧光Fm,此时所有反应中心处于关闭状态;等待几秒钟,开启作用光,此时荧光上升,然后随着光合作用的启动,荧光逐渐达到一个稳态,荧光达到稳态后测定的稳态荧光Fs;荧光达到稳态后开启饱和脉冲光测得光下最大荧光Fm’;接着作用光关闭,同时开启远红光测得荧光参数Fo’。用这五个基本参数计算我们在文献上见到的脉冲调制式荧光仪测定的参数,计算公式如下:
暗适应下PSⅡ的最大量子产额[FV/FM=(FM-FO)/FM];
光适应下PSⅡ的最大量子产额[FV’/FM’=(FM’-FO’)/FM’];
光适应下的PSⅡ反应中心开放的比例[qP=(FM’-FS)/(FM’-FO’)];
光适应下PSⅡ的实际光化学效率[ΦPSII=(FM’-FS)/FM’](Genty等1989);
光适应下的非光化学猝灭[NPQ=FM/FM’-1](Demmig-Adams和Adams1996)等
其他可以见到的参数也是根据这五个基本参数计算出来。
快速叶绿素荧光诱导动力学曲线:
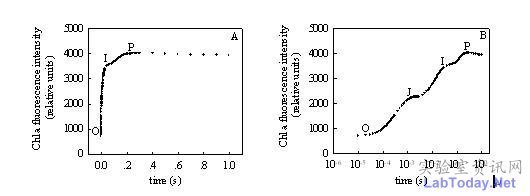
图2 用连续激发式荧光仪测定的快速叶绿素荧光诱导动力学曲线(图A: 时间坐标为线性形式;图B: 时间坐标为对数形式)
(注:引自李鹏民等文章“快速叶绿素荧光诱导动力学分析在光合作用研究中的应用”)
图2是典型的快速叶绿素荧光诱导动力学曲线,又称O-J-I-P曲线,测定该曲线,要求仪器的分辨率非常高,每秒记录10万次以上。为了更好的从曲线上获得信息,我们通常把时间坐标改为对数形式(图2B)。目前只有英国Hanshatech公司的HandyPEA植物效率分析仪,可以测定完整的快速叶绿素荧光诱导动力学曲线。
从快速叶绿素荧光诱导动力学曲线上,我们可以得到五十多个荧光参数,通过对曲线上参数的分析我们可以了解PSII的原初光化学反应及PSII的结构和功能的变化。主要应用在逆境生理、遗传育种(Maldonado-Rodriguez等2003)、病虫害防治(Bueno等2004)及污染检测(Appenroth等2001,Hermans等2003)等。有理由相信,随着该理论的进一步发展,快速叶绿素荧光诱导动力学将会在更多研究领域中得到更广泛的应用。
表1JIP-测定所用的快速叶绿素荧光诱导动力学曲线(O-J-I-P)的参数
Table 1 Formulae and glossary of termsused in the JIP-test in the analysis of the O-J-I-P fluorescencetransient
从OJIP快速叶绿素荧光诱导动力学曲线上直接获得的参数 | |
Ft | 暗适应后照光t时间时的荧光强度 |
F50μs或F20μs | 用PEA在暗适应后照光50μs时或用Handy-PEA在暗适应后照光20μs时测定的荧光强度 |
F100μs | 在暗适应后照光100μs时的荧光强度 |
F300μs | 在暗适应后照光300μs时的荧光强度 |
FJ≡F2ms | 在O-J-I-P荧光诱导曲线(图1B)J点处(2ms)的荧光强度 |
FI≡F30ms | 在O-J-I-P荧光诱导曲线(图1B)I点处(30ms)的荧光强度 |
FP | 在O-J-I-P荧光诱导曲线(图1B)的最大荧光处(P点)的荧光强度 |
tFM | 从暗适应后照光到到达最大荧光所需时间 |
Area | O-J-I-P荧光诱导曲线(图1B)、荧光强度F=FM及y轴之间的面积 |
从直接获得参数导出的其它参数 | |
FO≌F50μs或≌F20μs | 当所有反应中心完全开放时的荧光,即暗适应后的最小荧光强度 |
FM= FP | 当所有反应中心完全关闭时的荧光,即暗适应后的最大荧光强度 |
FV≡Ft - FO | 在t时的可变荧光强度 |
Vt≡(Ft - FO)/( FM -FO) | 在t时的相对可变荧光强度 |
VJ≡(FJ - FO)/( FM -FO) | 在J点的相对可变荧光强度 |
MO≡4(F300μs-FO)/( FM- FO) | O-J-I-P荧光诱导曲线(图1B)的初始斜率 |
Sm≡(Area)/( FM- FO) | 标准化后的O-J-I-P荧光诱导曲线(图1B)、荧光强度F=FM及y轴之间的面积 |
SS= VJ/MO | 用O-J相标准化的荧光上升互补面积 |
N≡Sm/ SS= Sm•MO•(1/VJ) | 从开始照光到到达FM的时间段内QA被还原的次数 |
比活性参数(QA处在可还原态时,单位PSⅡ反应中心的活性) | |
ABS/RC= MO•(1/ VJ)•(1/φPo) | 单位反应中心吸收的光能 |
TRO/RC= MO•(1/ VJ) | 单位反应中心捕获的用于还原QA的能量(在t=0时) |
ETO/RC= MO•(1/VJ)•ψO | 单位反应中心捕获的用于电子传递的能量(在t=0时) |
DIO/RC= (ABS/RC)- (TRO/RC) | 单位反应中心耗散掉的能量(在t=0时) |
量子产额或能量分配比率 | |
φPo≡TRO/ABS= [1-(FO/FM)] | 最大光化学效率(在t=0时) |
ψO≡ETO/TRO=(1-VJ) | 反应中心捕获的激子中用来推动电子传递到电子传递链中超过QA的其它电子受体的激子占用来推动QA还原激子的比率(在t=0时) |
φEo≡ETO/ABS=[1-(FO/FM)]•ψO | 用于电子传递的量子产额(在t=0时) |
φDo≡1-φPo =(FO/FM) | 用于热耗散的量子比率(在t=0时) |
比活性参数(照光材料单位横截面积的活性) | |
ABS/CSO≈FO | 单位面积吸收的光能(在t=0时) |
ABS/CSM≈FM | 单位面积吸收的光能(在t=tFM时) |
TRO/CSO=φPo•(ABS/CSO) TRO/CSM=φPo•(ABS/CSM) | 单位面积捕获的光能(在t=0时) 单位面积捕获的光能(在t=tFM时) |
ETO/CSO=φEo•(ABS/CSO) ETO/CSM=φEo•(ABS/CSM) | 单位面积电子传递的量子产额(在t=0时) 单位面积电子传递的量子产额(在t=tFM时) |
DIO/CSO= (ABS/CSO) -(TRO/CSO) DIO/CSM= (ABS/CSM) -(TRO/CSM) | 单位面积的热耗散(在t=0时) 单位面积的热耗散(在t=tFM时) |
反应中心的密度 | |
RC/CSO=φPo•(VJ/MO)•(ABS/CSO) RC/CSM=φPo•(VJ/MO)•(ABS/CSM) | 单位面积内反应中心的数量(在t=0时) 单位面积内反应中心的数量(在t=tFM时) |
性能指数 | |
PIABS≡(RC/ABS)•[φPo/(1-φPo)]•[ψO/(1-ψO)] | 以吸收光能为基础的性能指数 |
PICS≡(RC/CSO)•[φPo/(1-φPo)]•[ψO/(1-ψO)] PICS≡(RC/CSM)•[φPo/(1-φPo)]•[ψO/(1-ψO)] | 以单位面积为基础的性能指数(在t=0时) 以单位面积为基础的性能指数(在t=tFM时) |
推动力(性能指数的对数) | |
DFABS≡log(PIABS) | 以吸收光能为基础的推动力 |
DFCS≡log(PICS) | 以单位材料面积为基础的推动力 |
参考文献:
Appenroth KJ, Stöckel J, Srivastava A, Strasser RJ (2001).Multiple effects of chromate on the photosynthetic apparatus ofSpirodela polyrhiza as probed by OJIP chlorophyll a fluorescencemeasurements. Environ Pollut, 115: 49-64
Bueno M, Fillat MF, Strasser RJ, Maldonado-Rodriguez R, MarinaN, Smienk H, Gómez-Moreno C, Barja F (2004). Effects of lindane onthe photosynthetic apparatus of the cyanobacterium Anabaena.Environ Sci Pollut Res, 11: 98-106
Maldonado-Rodriguez R, Pavlov S, Gonzalez A, Oukarroum A,Strasser RJ (2003). Can machines recognise stress in plants?Environ Chem Lett, 1: 201-205
Genty B, Briantais JM, Baker NR (1989). The relationship betweenthe quantum yield of photosynthetic electron transport andquenching of chlorophyll fluorescence. Biochim Biophys Acta,990: 87-92
Demmig-Adams B, Adams WWIII (1996). Xanthophyll cycle and lightstress in nature: uniform response to excess direct sunlight amonghigher plant species. Planta, 198: 460-470
李鹏民, 高辉远, Strasser R J. 快速叶绿素荧光诱导动力学分析在光合作用研究中的应用. 植物生理与分子生物学学报,2005, 31(6): 559-566
Li PM, Gao HY, Strasser RJ. Application of the chlorophyllfluorescence Induction dynamics in photosynthesis study. Journal ofPlant Physiology and Molecular Biology, 2005, 31(6): 559-566
许大全. 光合作用效率. 上海: 上海科学技术出版社, 2002
 爱华网
爱华网

