一、总模式:

负极:还原剂,失电子→发生氧化反应(一般通式:M →Mn+ + ne-)
正极:氧化剂,得电子→发生还原反应(一般通式:N + me- →Nm-)
二、规则:
① 三大守恒规律:电荷守恒 电子守恒 质量守恒
②正负极得失电子相等(负失正得)
③用“=”不用“→”,气体用“↑”,沉淀不用“↓”
④两式相加后电子必须抵消
三、书写步骤:
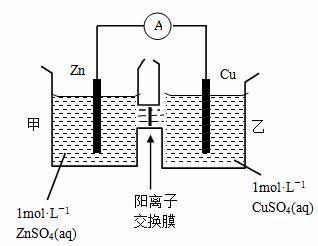
1、判断电池的正负极
方法:利用电极材料 电极现象 电子流向 电流流向 放电物质 离子流向等判断正负极
2、列物质 标得失
找出氧化剂 还原剂并标出化合价变化 确定得失电子的物质
3、选离子配电荷
根据电解质溶液环境确定生成的离子和参与反应的离子 并配电荷
4、巧用水,配平式
若需要水,则在两式的左边或右边加上H2O以获得H+ 或OH-
5、两式加,验总式
四、注意点:
(1)电极反应是一种离子反应,遵循书写离子反应式的一切规则(如“拆”、“平”)
(2)负极失电子所得氧化产物、正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在、在碱性溶液中以CO32-形式存在);
(3)氧气(氧原子得电子生成O2-)溶液中不存在O2-,在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与H2O结合成OH-。
(4)两极反应相加得到总反应,总反应减去负极反应得到正极反应、总反应减去正极反应得到负极反应。
(5)若正负极的产物会同所处的电解质溶液反应的话,则必须考虑产物同电解质溶液的反应。即电极反应的产物必须能稳定地存在与电解质溶液中。
比如:银做负极失去电子Ag-e-=Ag+,如果溶液中含有Cl-,Cl-与生成的Ag+反应,则电极反应变为Ag-e-+Cl-=AgCl,再如:铅蓄电池中,铅做负极失去电子变成Pb2+,溶液中有SO42-,与子反应生成硫酸铅:Pb2+-2e-+SO42-=PbSO4。
五、书写技巧
1.若知道电池总反应,根据总反应是两电极反应之和,若能写出某一极反应或已知某一极反应,由总反应减半反应可得另一极反应。
2.若电极反应产物是难溶性碱或盐时,负极上一般有阴离子参与反应,若为可逆电池,则正极上有同样的阴离子生成,电解液的浓度基本不变。阳离子一般参与正极反应。参加电极非氧化还原反应的阴、阳离子可依据电解液类型或反应产物确定。
3.同时书写同一电池两极反应时,应注意两极电子得失数目相等。
4.电极半反应一般为离子反应,书写电极半反应和书写离子方程式有相似的地方,应考虑反应产物与电解液中的离子能否共存。若不能共存,则按实际产物书写。
5.电池半反应中,存在质量守恒和电荷守恒。书写时应据此配平半反应。电荷的计算方法是:电子带负电,一个电子相当一个单位负电荷,得一个电子相当于加一个负电荷,失去一个电子相当于加一个正电荷。若离子、电子分布在同一边,则电荷的代数和为零;若离子、电子分布在等号的两边,则两边电荷的差为零。因为负极失去电子,正极得到电子,根据电荷守恒,负极通常有较多的阴离子参加反应或有阳离子生成;正极通常有较多的阳离子参加反应或有阴离子生成。
6.一般电解液中有水,电极反应是在水溶液中进行,配平半反应时,根据需要,水可作反应物也可作产物。一般是等号左边若有H+或OH—参与反应,则等号右边可能有水生成;等号左边若有水参与反应,则等号右边可能有H+或OH—生成。
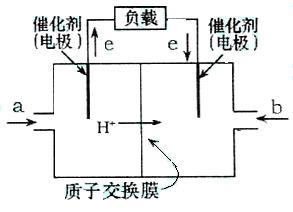
六:燃料电池:
(1)一般负极为可燃气体发生氧化反应,正极为助燃气体如氧气发生还原反应。
(2)电极一般不参与反应,常见的有金属铂(Pt)或石墨棒。
(3)产物与溶液的酸碱性有关
(4)氢氧燃料电池中,负极氢气放电生成H+,若在碱性环境中则产物为水。反应为H2-2e-+2OH-=2H2O,有机物燃烧生成CO2,在碱性溶液中与OH-反应以CO32-形式存在。
(5)正极反应时的书写:处于正极的氧气得电子由O价变为-2价的O2-
①若此时电解质溶液为酸性,则反应过程可以理解为:正极上首先发生:O2+4e- = 2O2-由于在酸性环境中大量存在H+故O2-会与H+结合成H2O,故正极反应式应为:O2+4e+4H+=2H2O;
②当然若电解质为中性或碱性时,则正极反应式就应只是O2+4e-+2H2O= 4OH-。此时负极的反应式就可以由总电极方程式减去正极的电极方程式得到!
补充几种常见电池电极反应
1、锂电池负极:Li-2e-=Li+正极:I2+2e-=2I-
总反应:2Li+I2=2LiI
2、 氢镍电池 碱性介质中
负极:
正极:
总反应:
3、镍镉电池
放电反应式: 负极反应:Cd+2OH-=Cd(OH)2+2e-
正极反应:2e-+NiO2+2H2O=Ni(OH)2+2OH-
总反应:Cd+NiO2+2H2O=Cd(OH)2+Ni(OH)2
充电反应式:正极反应:Ni(OH)2+2OH-=2e-+NiO2+2H2O
负极反应:Cd(OH)2+2e-= Cd+2OH-
总反应: Cd(OH)2+Ni(OH)2=Cd+NiO2+2H2O
4、AL-空气-海水海水电池。H2O中的OH-参与负极反应,可以直接写成OH-
负极:AL-3e-+3OH-=Al(OH)3
正极:O2+4e-+2 H2O=4OH-
总:4 AL+3 O2+6H2O=4 Al(OH)3
5、甲醇、空气(含CO2),与碳酸锂熔融盐燃料电池。甲醇被氧化,因此通甲醇的一极是负极,CO32-参与反应。
负极:CH3OH-6e-+3CO32-=4CO2+2 H2O(失电子,电荷平衡)
正极:O2+4e-+2CO2=2CO32-(得电子,电荷平衡)
总:2CH3OH+3O2=2CO2+4H2O
6、乙醇燃料电池/(碱液)
负极:C2H5OH-12e-+16OH-=2CO32-+11H2O正极:O2+4e-+2H2O=4OH-
总反应:C2H5OH+3O2 +4OH-=2CO32-+5H2O
7、C4H10、O2/(ZrO2,传导O2-)
负极:C4H10-26e--13O2-=4CO2+5H2O正极:O2+4e-=2O2-
总反应:2C4H10+13O2=8CO2+10H2O
8、CO燃料电池(总反应方程式均为: 2CO + O2 =2CO2)
(1)、熔融盐(铂为两极、Li2CO3和Na2CO3的熔融盐作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气)
正极: O2 +4e- + 2CO2 =2CO32- (还原反应)
负极:2CO+2CO32- – 4e-==4CO2 (氧化反应)
(2)、酸性电解质(铂为两极、电解液H2SO4溶液)
正极: O2 + 4e-- +4H+ ==2H2O (还原反应)
负极: 2CO – 4e- + 2H2O== 2CO2+4H+(氧化反应)
 爱华网
爱华网