新药申请的时间从研发到生产上市,则需要更长的时间才能获批上市,而这几年的医药市场瞬息万变,各种不确定因素非常之大,因此可以说,新药研发是一项开发周期长、资金投入大、不可预测因素多的系统工程,具有较高的风险性。
例如,2013年中国十大重磅处方药之富马酸卢帕他定片,为3.1类新药.2005年申报临床(受理号:CXHL0502449)2006年11月获临床批文,临床后于2009年申报生产(受理号:CXHS0900311)2013年5月获生产批件(批准文号:国药准字H20130047)该过程历经大约7-8年,这还不包括前期的临床前研究工作时间。
小贴士:上述的受理号,C代表国内注册,X代表新药,H代表化药。L申请临床,S申请生产。
CXHL0502449表示国内化药新药申请临床,05表示2005年申报临床,CXHS0900311表示09年国内化药新药申请生产。
小贴士:一个完整的批准文号由国药准字H(Z、S、J)+4位年号+4位顺序号所组成.
其中H代表化学药品,Z代表中药,S代表生物制品,J代表进口药品分包装。国药准字有效期为5年。国药准字H20130047即化药2013
根据化学药品注册分类,共分为6类。根据药品注册管理办法规定,5类以上新药均按照新药申请的程序申报。具体分类请看下表:
分类 | 定义 | 举例 |
1 | 未曾在中国境内上市销售的药品的注册申请 | 阿利沙坦酯片 |
2 | 改变给药途径且尚未在国内外上市销售的制剂 | 甲磺酸帕珠沙星滴眼液 |
3 | 已在国外上市销售但尚未在国内上市销售的药品 | 非布司他片 |
4 | 改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂 | 马来酸恩替卡韦片 |
5 | 改变国内已上市销售药品的剂型,但不改变给药途径的制剂 | 盐酸西替利嗪口腔崩解片 |
6 | 已有国家药品标准的原料药或者制剂 | 略 |
注:1类又细分6小类,3类细分4小类。详细可参阅药品注册管理办法附件2。
一般药品研发的大致流程及相应花费时间如下:
立项(4月)→临床前研究(9-24月)→CDE待批临床(大于1年)→临床试验→CDE待批生产(1年-n年)→批文生产转移(约6个月)
注:CDE国家食品药品监督管理局药品审评中心英文缩写,其职能主要对新药、仿制药、补充申请等进行审评。
立项:简单的说在确定开发某品种前,需要进行一系列市场调研工作,通过对市场,流行病学,技术,疗效和安全,知识产权,成品成本,国家政策,企业自身条件等方面的考察,来确定研发品种或治疗某类疾病药物上市后的市场潜力,从而选择适合本企业的品种。一般需要几个月时间来立项。立项决定了该品种的将来市场,因此立项至关重要。
临床前研究:一般品种的研发流程如下:
小试产品→药效筛选→制备工艺优化数据→质量标准→中试放大→药理毒理→药剂工艺→稳定性实验→资料整理报批
由于这个过程需要稳定性试验,即使最简单的品种一般需要9个月研究过程,因此基本都需要12个月到24个月时间研究。该阶段可能影响时间的关键在于合成原料的工艺摸索或制剂处方摸索是否顺利。临床前研发,一定要研究透彻,不仅利于申报后尽可能少的发补资料甚至不发补,尽快获批,更有利于将来获批后顺利生产上市。
例如:盐酸莫西沙星其原研德国拜耳,2012年在国内的销售额达到15亿元,南京优科制药有限公司首仿获批。仟源制药的莫西沙星近期遭到通知补充资料。这意味着该药品的审评时间将延长,抢“二仿”的步伐也将放缓,而申报生产的企业多达数十家,因此该品种抢“二仿”的竞争也将更加激烈。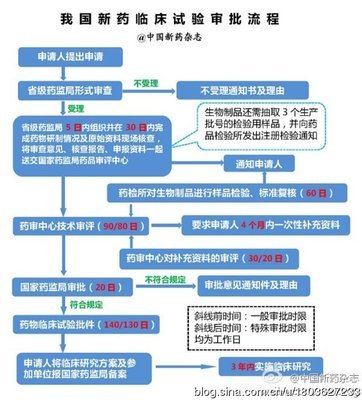
CDE待批临床:根据药品注册管理办法相关规定,省局30日内完成资料的形式审查,注册现场核查等,但可能由于补充资料等等事宜,往往时间会超过30天。国家局CDE:新药临床试验:90日;获准进入特殊审批程序的品种:80日。(以上均为工作日)。
由于申报品种之多,CDE任务之重,一般申报资料送达CDE后,需排队待审,排队待审时间可短可长,笔者有个品种的申报资料2011年送CDE,今年才进入审评。因此说临床批件1年获批是最快的时间了,也许会2年,3年,各种情况都有。
临床试验:半年基本指生物等效性试验,3年左右是根据各类新药视类别不同进行Ⅰ、Ⅱ、Ⅲ、Ⅳ期临床试验各种新药类别而进行的不同临床。临床试验,关键要找对药物临床研究机构,选择口碑好,经验丰富的临床机构,临床方案设计的好坏直接影响到是否获批。
CDE待批生产:药品注册管理办法中申报新药生产:150日;获准进入特殊审批程序的品种:120日。该时限为审评时限,也就是说进入CDE开始审评的时限,同CDE待批临床一样,需要排队待审。CDE审评结束后,送国家局审批,批准生产,获国药准字。因此说1年能批下来也是最快的时间了。
生产批件的转移:这个过程企业可控,主要是试生产,申报物价上市等,如需要进行GMP认证工作,基本6个月也能完成。
从以上研发流程不难看出,企业在申报新药时,在立项、临床前研究、临床试验等方面,主要难点在于技术研究和攻关,在一定程度上是可控的。而资料送国家局之后,从目前审批的时限以及众多报批企业的排队情况来看,漫长的等待期让企业备受煎熬。
因此,一个新药走完所有流程,怎么也得花7-8年的时间,还要投入巨大的人力财力并面临难以预估的风险,也只有实力并有战略眼光的企业愿意投入到新药研发上。而走研发创新的企业往往最后也成为了业界的翘楚。
 爱华网
爱华网