无机化学实验“氯化钠的提纯”的教案
“氯化钠的提纯”是一个在中学化学和大学无机化学中都曾出现过的实验内容。虽然并不复杂,但其中涉及的基本知识、基本原理、基本操作,还是不少的。
为使学生对某实验的内容有更深刻理解,应该设计出一系列有一定深度的问题,来帮助学生对这个实验进行分析和思考。当所有学生都能回答出这些问题时,才算真正达到了本次实验的目的。
针对本实验,除原教材提出的3个问题外,笔者又补充了13个有一定深度的问题。恳请同仁能再提出一些可供学生思考的问题。
一、学生预习内容
1. 实验教材中的实验内容(包括固液分离、浓缩结晶等操作)。
2. 以前学过的有关基本操作,如煤气灯使用、量筒、托盘天平、pH试纸使用、试样溶解等内容。
二、实验目的
1. 练习固体、液体试剂取用,溶解、过滤、蒸发与结晶等基本操作;
2. 学习用沉淀法除去杂质离子而提纯粗食盐的方法;
3. 学习SO42-、Mg2+、Ca2+离子的检验方法。
三、实验原理
1. 用化学方法提纯氯化钠的原理
所谓用化学方法提纯氯化钠,就是用某些化学试剂(如沉淀剂)来去除粗食盐中的杂质离子。
沉淀剂的选取原则有两点:一方面要使杂质离子沉淀的较完全(浓度小于1×10-5mol·L-1);另一方面,最好能不引入新的杂质离子(或引入的新离子较易被除去、并最终能被完全除去)。
本实验采用的方法为:
加入BaCl2溶液去除SO42-,SO42-+Ba2+= BaSO4↓(为使SO42-沉淀完全,BaCl2必须要过量,这样就引入了杂质离子Ba2+。但在后面能去除Ca2+时,可同时将Ba2+也去掉);
需先过滤掉BaSO4,然后才能进行下面的加NaCO3操作。这是因为:在有BaSO4沉淀存在的情况下加NaCO3,会有部分BaSO4与NaCO3发生反应BaSO4+CO32- = BaCO3+SO42-(沉淀转化),使SO42-重新进入溶液。
加入NaOH去除Mg2+,Mg2++2OH-= Mg(OH)2↓(会引入了OH-);
加入NaCO3去除Ca2+、Ba2+,Ca2++CO32-= CaCO3↓,Ba2++CO32-= BaCO3↓(要引入了CO32-);
过滤去掉沉淀后,在滤液中加HCl去除OH-、CO32-。反应为H++ OH- = H2O,2H+ + CO32- = H2O +CO2(但又引入了H+);
CO2和大部分HCl在蒸发结晶时会被除去。
少量的K+,则残留在母液中(因而在实验中不得将母液蒸干)。在过滤出NaCl后K+随母液弃去。
还有少部分的HCl在干燥时会被除去。
2. 产品质量检验的原理
判定杂质离子是否存在,要采用灵敏度高的离子鉴别方法:
SO42-用BaCl2来检验;Ba2++ SO42- = BaSO4;
Ca2+用(NH4)2C2O4来检验;Ca2++ C2O42- =CaC2O4;
Mg2+用镁试剂来检验Mg2+ + 2OH- =Mg(OH)2
()。
四、实验步骤
1.粗食盐的提纯
(制备实验的实验步骤,可以用如下的操作流程图来表示)
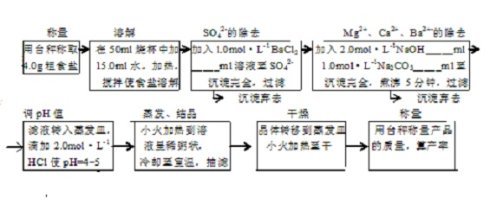
(在实验报告中,各沉淀剂用量都要是具体的数值,不得有“2-3ml”的字样;“pH=4-5”同样也仅是一个结果范围的提示,在报告中要填写实测值)
2.产品纯度的检验
见教材中的表格。但除填写表格外,还要有有关产品质量的文字性结论。
五、对实验报告的要求
报告的书写格式(见教材)要规范。要有“实验原理”部分。
报告中要有经教师签字确认的实验原始数据。
产率为提纯后得到的食盐与粗实验质量之比。
六、基本操作补充
胶头滴管的洗涤:要用2个烧杯,分别装自来水和去离子水。滴管中的废液排入废液缸后,先将滴管用自来水洗3遍,再用去离子水洗3遍。洗后将其浸泡在装有去离子水的烧杯中,备用。
固液分离法有3种:倾析法、过滤法、离心分离。
减压过滤的适用范围:温度不高的悬浊液、非胶体的沉淀。
七、基本数据
在25℃时NaCl的溶解度为:36.0g/100g水中。
由BaSO4的Ksp=1.1×10-10;
PbSO4的Ksp=1.8×10-8;
SrSO4的Ksp=3.4×10-7;
Ag2SO4的Ksp=1.2×10-5;
CaSO4的Ksp=1.1×10-4。
在上述5种硫酸盐中,1.1×10-10最小。可见用Ba2+沉淀SO42-的效果最好。
Mg(OH)2的Ksp=5.1×10-12;
Mg CO3的Ksp=6.8×10-6。可见,用OH-沉淀Mg2+的效果最好。
CaCO3的Ksp=4.9×10-9;
Ba CO3的Ksp=2.6×10-9。用CO32-可将Ca2+、Ba2+沉淀的很完全。
八、知识补充
沉淀完全的要求为;该离子的浓度要小于1.0×10-5mol·L-1。
加快可溶性固体物质溶解速度的几种方法:研细、搅拌、加热。
九、思考题答案
1.过量的Ba2+离子是如何除去的?
沉淀SO42-时,作为杂质的过量的Ba2+(为保证SO42-沉淀完全),可以在其后的操作步骤、加入Na2CO3溶液时,与Ca2+一同时被除去。
2.蒸发前用盐酸调pH值的目的是什么?
在酸性条件下,才能使杂质离子OH-、CO32-与H+完全反应,变为H2O和CO2。在蒸发中被除去。
3.去除SO42-离子除用BaCl2外,还可以用别的试剂吗?试举出1-2例。
一是,可以用其它挥发性酸的钡盐(酸根的干扰,可用酸的挥发性而去除掉)。如,醋酸钡、硝酸钡。硝酸钡明显不如醋酸钡,因为进行硝酸分解试验要考虑排风的问题。
二是,从溶度积考虑,还可以用铅盐(因为PbSO4的Ksp也很小)。但PbCl2难溶,可供选择的只有醋酸铅与硝酸铅,显然醋酸铅要更好些。
由于Ag2SO4的溶度积已很大(Ksp=1.2×10-5),不宜用AgNO3来“沉淀”SO42-离子。CaCl2就更没有考虑的必要了(CaSO4的Ksp=1.1×10-4,更大)。
十、其它问题
1. 粗食盐中含有哪些杂质?其中的不溶性杂质是如何去除的?
粗食盐中含有不溶性、及可溶性,这样两类杂质。不溶性的如泥沙、草屑等。可溶性的有SO42-、Mg2+、Ca2+、K+等离子。其中,SO42-、Mg2+、Ca2+的量均较大,K+离子已经很少,而其它离子的含量当然就更低了。
不溶性杂质在过滤除掉BaSO4时,可以一并被除去。没有必要为除不溶性杂质,安排一个单独的实验步骤。
2.在本实验中,是否可以用自来水来溶解粗食盐?
可以用自来水。因为自来水中的杂质离子,比起粗食盐来要少得多,且按本实验所给的方法也都可除去。
3.溶解粗食盐,要用多少水才合适?
溶解粗食盐所用水的量,应该由食盐的溶解度算出。水过少食盐不能完全溶解;水过多蒸发时浪费时间和能源。
但水的量可以较配制饱和溶液时稍多些,这样食盐溶解的快;况且在加热、煮沸时还要有水的损失;只要在过滤除去Mg(OH)2和CaCO3及之前,不要有食盐晶体析出即可。
4. 检验离子是否沉淀完全的方法?
静置至溶液澄清。沿器壁加少量沉淀剂。如又产生浑浊,说明该离子沉淀的不完全;如无变化,说明该离子已沉淀完全。
5.加BaCl2后,为什么要加热煮沸?在已判定SO42-沉淀完全后,还要加热溶液3-5分钟?
沉淀SO42--时,加热的目的是使沉淀老化、颗粒变大,便于沉降和过滤。
沉淀OH-、CO32时,要加热溶液的原因也是如此。
6.分离BaSO4时,为什么要趁热过滤?
一是,过滤的速度可以更快一些。
更主要的是,对于接近饱和的浓溶液,在过滤中温度降低到一定程度时可能会有晶体析出(降低温度使物质的溶解度减小),使过滤操作难于进行(晶体堵住漏斗的支管)。这时,就要考虑用热滤漏斗来进行“热过滤”。
好在氯化钠的溶解度随温度变化不大。只要趁热过滤就可以,还没有必要用“热过滤”。
7. 在过滤操作后,对BaSO4沉淀应否还应该进行“洗涤”?
BaSO4沉淀作为废弃物,没有洗涤的必要。
至于滤纸上沾有的少量NaCl,对产率也没有多大的影响。也没有回收的必要。
如果,由于煮沸而蒸发掉的水较多,需要补充一些水时,借此机会补充些水也无妨。但用于“洗涤”的水过多,以致影响到蒸发与结晶要用更多的时间,就得不偿失了。
8. 沉淀Mg2+、Ca2+离子时,NaOH与NaCO3溶液是否一定要依次加入?
从反应的原理看,次序对杂质离子是否能去除完全不会有影响。只要最后再用NaOH、NaCO3溶液检验,杂质离子已沉淀完全了,就可以。
但作为一项科学实验,NaOH终归是用来沉淀Mg2+的。分别测出这两种试剂的用量,获取更细致一些的信息,对未来的化学工作者还是有一定意义的。
9.减压过滤操作的要领有哪些?
吸滤瓶与布氏漏斗上的单孔塞要配套。即胶塞插入瓶内的高度,不得超过其高度的1/2(防止被吸入过多,而取出困难)。且布氏漏斗颈的尖嘴,应与吸滤瓶的支管,处于相反的方向(防止滤液被气泵的气流带走)。
布氏漏斗中的滤纸要大小刚好盖住所有的小孔。并用水湿润,以便滤纸能紧密地附着在布氏漏斗上。
过滤时,要先打开排气泵的开关后,才能将待过滤倒入布氏漏斗(防止滤纸被滤液飘起)。
结束过滤时,要先拆下与气泵相连的吸滤瓶的胶管,然后再关掉排气泵(防止循环水抽气泵中的水倒吸入吸滤瓶)。
10.本实验的产率是否有可能超过100%?
有可能。因为在加入的BaCl2、HCl中有Cl-离子;在NaOH、NaCO3中有Na+离子。这些试剂加的过多,都会使“产率”增加。所以不能只用产率高低来判定实验是否成功。
11.产品检验时,常有SO42-反而比粗食盐中还多的现象(加入BaCl2溶液后,沉淀明显),原因是什么?
这多数是由于调pH值不仔细,溶液的酸度不够,CO32-未能完全除去(检验时生成BaCO3沉淀)而引起的。可用加稀HCl的方法,判别沉淀是否是BaCO3。
12.在CO32-存在时,BaSO4沉淀会转化为BaCO3,重新释放出SO42-离子的理论依据?
对反应BaSO4+CO32- = BaCO3+SO42-,
平衡常数。
即,如果溶液中[CO32-]>2.4×10-4,BaSO4就重新溶解而造成[SO42-]>1.0×10-5。且[CO32-]越大,[SO42-]也随之增大。在溶液中始终有[CO32-] :[SO42-]≈ 24:1,这样的平衡关系。
13.制取试剂级NaCl的方法为:
在接近饱和的NaCl溶液中,通入HCl气体,利用Cl-的同离子效应,可以只让NaCl晶体析出。
建议:
没有必要取8克(或20克)粗食盐,来完成这个实验。作为一种方法的掌握,取4.0克食盐就可以。否则蒸发结晶要用很长的时间。
参考文献
[1] 北京师范大学无机化学教研室.无机化学实验.高等教育出版社.1983
 爱华网
爱华网