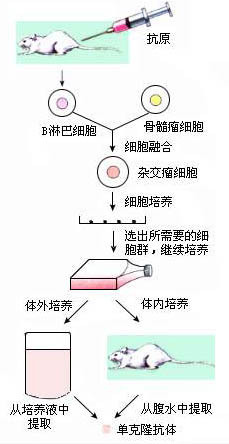
在单克隆抗体的制备过程中,筛选产生单一抗体的特异性杂交瘤细胞是本技术的关键步骤。在细胞混合物中含有骨髓瘤细胞、B淋巴细胞、骨髓瘤细胞与骨髓瘤细胞的融合细胞、B淋巴细胞与B淋巴细胞的融合细胞、骨髓瘤细胞与B淋巴细胞融合形成的杂交瘤细--胞,通常采用HAT培养液进行筛选培养,由于B淋巴细胞不能在体外天然增殖,因而未融合的B淋巴细胞以及B淋巴细胞与B淋巴细胞的融合细胞不能在HAT培养液中培养。骨髓瘤细胞是次黄嘌呤-鸟嘌呤磷酸核糖转移酶缺陷型(HGPRT—)细胞,因而未融合的骨髓瘤细胞以及骨髓瘤细胞与骨髓瘤细胞的融合细胞在HAT培养液中不能利用次黄嘌呤作为前体合成鸟嘌呤和腺嘌呤,同时在HAT培养液中加入的氨基蝶呤阻断了利用脱氢叶酸还原酶合成嘌呤的第2条代谢途径,于是它们也不能增殖生长。只有骨髓瘤细胞与B淋巴细胞融合形成的杂交瘤细胞可以在HAT培养液中增殖生长,因为杂交瘤细胞从B淋巴细胞处获取了HGPRT,可以利用培养液中的外源次黄嘌呤,而培养液中添加的胸腺嘧啶可以克服由于氨基蝶呤抑制脱氢叶酸还原酶而阻碍的嘧啶合成。这样,在细胞融合大约10~14d之后,HAT培养液中只有骨髓瘤细胞与B淋巴细胞融合形成的杂交瘤细胞能够增殖生长。由于不同效应B细胞的特异性存在差异,经HAT培养液第一次筛选出的杂交瘤细胞产生的抗体可能不同,还必须对杂交瘤细胞群进行二次筛选,才可能筛选出产生特定抗体的杂交瘤细胞。二次筛选通常采用有限稀释克隆细胞的方法,将杂交瘤细胞多倍稀释,接种到多孔细胞培养板上,使培养板的每孔中只有一个细胞,通过培养使细胞增殖,然后可用酶联免疫吸附试验法检测每孔上清液中细胞分泌的抗体类型。上清液中能与特定抗原结合的培养孔即为阳性孔,阳性孔中的细胞还不能保证是来自单个细胞,继续进行有限稀释,一般重复3、4次,直至确定每孔中细胞为单克隆细胞。
在动物免疫中,应选用高纯度抗原。一种抗原往往有多个决定簇,一个动物体在受到抗原刺激后产生的体液免疫应答,实质是众多B细胞群的抗体分泌。而针对目标抗原表位的B细胞只占极少部分。由于细胞融合是一个随机的过程,在已经融合的细胞中,有相当比例的无关细胞的融合体,需细筛选去除。筛选过程一般分为两步进行:一是融合细胞的抗体筛选,二是在此基础上进行的特异性抗体筛选。将融合的细胞进行充分稀释,使分配到培养板的每一孔中的细胞数在0至数个细胞之间(30%的孔为0才能保证每个孔中是单个细胞),培养后取上清以ELISA法选出抗体高分泌性的细胞;这一过程常被习惯地称作克隆化。将这些阳性细胞再进行克隆化,应用特异性抗原包被的ELISA找出针对目标抗原的抗体阳性细胞株。
酶联免疫吸附剂测定
enzyme linked immunosorbentassay,ELISA
指将可溶性的抗原或抗体吸附到聚苯乙烯等固相载体上,进行免疫反应的定性和定量方法
基本原理是:①使抗原或抗体结合到某种固相载体表面,并保持其免疫活性。②使抗原或抗体与某种酶连接成酶标抗原或抗体,这种酶标抗原或抗体既保留其免疫活性,又保留酶的活性。在测定时,把受检标本(测定其中的抗体或抗原)和酶标抗原或抗体按不同的步骤与固相载体表面的抗原或抗体起反应。用洗涤的方法使固相载体上形成的抗原抗体复合物与其他物质分开,最后结合在固相载体上的酶量与标本中受检物质的量成一定的比例。加入酶反应的底物后,底物被酶催化变为有色产物,产物的量与标本中受检物质的量直接相关,故可根据颜色反应的深浅刊物定性或定量分析。由于酶的催化频率很高,故可极大地地放大反应效果,从而使测定方法达到很高的敏感度。
 爱华网
爱华网