百科名片
过氧化钙氧化物(oxide)是指由两种元素组成且其中一种是氧元素的化合物,如二氧化碳(CO₂)、氧化钙(CaO)等。
编辑本段分类
氧化物按照是否与水生成盐,以及生成的盐的类型可分为:酸性氧化物、碱性氧化物、两性氧化物、不成盐氧化物、假氧化物、过氧化物、超氧化物、臭氧化物和类似氧化物九类。(另外还有很多复杂的氧化物。) 氧化物属于化合物,(当然也一定是纯净物)。其构成中只含两种元素,其中一种一定为氧元素(定义)(狭义上地,氟和氧的化合物不属于氧化物),另一种若为金属元素,则为金属氧化物;若为非金属,则为非金属氧化物。编辑本段酸性氧化物
我们知道,碱跟酸反应生成盐和水,碱跟某些非金属氧化物反应,也生成盐和水, 例如 : 2NaOH+H₂SO₄=Na₂SO₄+2H₂O ; 2NaOH+CO₂=Na₂CO₃+H₂O ; Ca(OH)₂+SO₃=CaSO₄+H₂O 。 上述反应表明,二氧化碳,三氧化硫跟酸的性质相似。因此,人们把二氧化碳,三氧化硫这样能跟碱反应生成盐和水的氧化物,称为酸性氧化物.。 非金属氧化物大多数是酸性氧化物,我们熟悉的非金属氧化物中,一氧化碳不是酸性氧化物。 酸性氧化物大多数能跟水直接化合生成含氧酸, 例如: CO₂+H₂O=H₂CO₃ ; SO₃+H₂O=H₂SO₄ 。 含氧酸也可以受热分解生成酸性氧化物.例如,将硫酸加热可得到三氧化硫和水: H₂SO₄=SO₃↑+H₂O 在这里三氧化硫可以看做是硫酸脱水后的生成物,因此也把酸性氧化物叫做酸酐。 酸性氧化物(可以与水反应生成酸)可以与碱发生反应, 例如:2NaOH + SiO₂ = Na₂SiO₃ + H₂O。 实际上可以把这样的反应看做是SiO₂与水反应生成硅酸,硅酸又与氢氧化钠发生反应生成硅酸钠与水。因为生成了同量的水,所以在反应物中省去了水。所以盛放氢氧化钠溶液必须使用用橡胶塞(硅酸钠有很强的粘性)。编辑本段碱性氧化物
跟酸起反应,生成盐和水的氧化物,叫做碱性氧化物.大多数金属氧化物是碱性氧化物.例如氧化钠、氧化钾、氧化钡…… : 能跟酸起反应,生成盐和水的氧化物叫碱性氧化物(且生成物只能有盐和水,不可以有任何其它物质生成,且能与水反应生成碱)。碱性氧化物一般不与正盐、碱式盐(如Mg(OH)Cl)反应,但可与酸式盐(如NaHSO4)反应。碱性氧化物包括活泼金属氧化物和其他金属的低价氧化物,如Na2O、CaO、BaO和CrO、MnO。碱性氧化物的对应水化物是碱。例如,CaO对应的水化物是Ca(OH)2,Fe2O3对应的水化物是Fe(OH)3。碱金属和钙、锶、钡的氧化物能跟水反应,生成相应的氢氧化物。它们都是强碱: Na2O+H2O==2NaOH CaO+H2O==Ca(OH)2 高温下,碱性氧化物和酸性氧化物作用生成盐: CaO+SiO2==CaSiO3 碱性氧化物与酸性氧化物反应: Na2O+CO2==Na2CO3 碱性氧化物受热时比较稳定,一般不会分解。 碱性氧化物一定是金属氧化物,而金属氧化物不一定是碱性氧化物,如Mn2O7就是酸性氧化物,Al2O3、BeO、Cr2O3、ZnO,MnO2为两性氧化物。 碱性氧化物还可以和对应的酸式盐反应——Na20+2NaHSO4===2Na2SO4+H2O 当然,碱性氧化物只是从理论上可以视为对应碱脱水后的产物,并不是所有碱性氧化物都可以与水反应生成对应的碱。 注意:★能与酸反应的氧化物不一定就是碱性氧化物,如SiO2可以与HF反应,但SiO2却是酸性氧化物(应要注意,SiO2可以与HF反应是SiO2的特性,与它是碱性氧化物或酸性氧化物无关!)。 ★碱金属的氧化物不一定就是碱性氧化物,如Na2O2可以和水反应生成碱,但它是过氧化物而不是碱性氧化物。编辑本段两性氧化物
因为是临界元素,所以既有一定金属性,也有一定非金属性,同时能与强酸强碱反应,故称之为两性,对应水化物也是两性氢氧化物 如:Al₂O₃ ZnO BeO 2Al₂O₃+6HCl=2AlCl₃+3H₂O Al₂O₃+2NaOH=2NaAlO₂+H₂O编辑本段不成盐氧化物
不能跟酸起反应生成盐和水,又不能跟碱起反应而生成盐和水,这类氧化物叫做不成盐氧化物。例如,H₂O、NO、CO、N₂O、N₂O₄、TeO、ClO₂、I₂O₄、MnO₂属于不成盐氧化物。 一氧化碳能跟氢氧化钠起反应,生成甲酸的钠盐。但是在生成盐时没有生成水,所以一氧化碳仍属于不成盐氧化物。 二氧化锰、二氧化氮是不成盐氧化物,因为锰和氮的含氧酸对应这两种元素的化合价都不是+4 。 高锰酸根对应的氧化物是七氧化二锰而不是二氧化锰。 硝酸根对应的氧化物是五氧化二氮而不是二氧化氮。 这里需要说明的是:有些不成盐氧化物在一定条件下是可以“成盐”的。如CO,在工业上制备甲酸,就是利用CO和NaOH在一定条件下反应来制取的: CO + NaOH → HCOONa 在中学阶段,我们将CO划分到不成盐氧化物类,是因为中学化学中还没有涉及象上述的用CO制甲酸这方面的知识。同时也提示我们:在教学中,不能将某些概念或定义讲得太死,要留有一定的余地,注意出现特殊情况。编辑本段假氧化物
有些元素和氧的二元化合物,从分子组成上看是氧化物,但实际并不是氧化物且结构比较复杂。我们将这类氧化物称做假氧化物。编辑本段过氧化物
过氧化物,是由于分子中含有过氧基或过氧离子而得其名。此外具有极弱酸性的过氧化氢与碱作用,也可生成过氧化物。因此,过氧化物也可看作是过氧化氢的盐。能生成过氧化物的金属,主要是碱金属和碱土金属。编辑本段超氧化物
金属性特别活泼的碱金属和碱土金属,在一定条件下,在过量的氧气中燃烧时,可生成比过氧化物含氧量更高的氧化物。例如NaO4等,我们称之为超氧化物。另外,超氧化氢也属于超氧化物。超氧化物中的超氧离子,是分子作为一个整体获得一个电子后形成的,因此稳定性很差,是很强的氧化剂。编辑本段臭氧化物
常见的臭氧化物大都是比较活泼的碱金属的氧化物,例如、等。它们是通过臭氧()与碱金属氢氧化物反应制备而得其名的。编辑本段类似氧化物
这类化合物从它们的分子组成上看符合氧化物的定义,但是氧元素在分子中的化合价分别为+2和+l价,是电子的提供者而不是获得者,因而不称作氧化物。为了说明符合氧化物定义而又不属于氧化物的现象,我们称这类化合物为类似氧化物。编辑本段氧化物分类(不同角度)
①金属氧化物与非金属氧化物 ②离子型氧化物与共价型氧化物 离子型氧化物:部分活泼金属元素形成的氧化物 如Na₂O、CaO等 共价型氧化物:部分金属元素和所有非金属元素的氧化物 如MnO₂、HgO、SO₂、ClO₂ 等 ③普通氧化物、过氧化物和超氧化物 ④酸性氧化物、碱性氧化物和两性氧化物、不成盐氧化物、其它复杂氧化物 1. 酸性氧化物大多数能跟水直接化合生成含氧酸. CO₂+H₂O=H₂CO₃ SO₃+H₂O=H₂SO₄ 含氧酸也可以受热分解生成酸性氧化物.例如,将硫酸加热可得到三氧化硫与水 2. 同时能与强酸强碱反应,故称之为两性如:Al₂O₃ ZnO BeO 3. 不能跟酸起反应,又不能跟碱起反应而生成盐和水,这类氧化物叫做不成盐氧化物。 例如,H₂O、NO、CO、N₂O、NO₂、N₂O₄、TeO、ClO₂、I₂O₄、MnO₂属于不成盐氧化物。 (1) 一氧化碳能跟氢氧化钠起反应,生成甲酸的钠盐。但是在生成盐时没有生成水,所以一氧化碳仍属于不成盐氧化物。 (2)二氧化锰、二氧化氮是不成盐氧化物,因为锰和氮的含氧酸对应这两种元素的化合价都不是+4 。 (3) 高锰酸根对应的氧化物是七氧化二锰而不是二氧化锰。 (4) 硝酸根对应的氧化物是五氧化二氮而不是二氧化氮。编辑本段不同类别的氧化物之间的相互关系
(1)酸性氧化物不都是非金属氧化物, 非金属氧化物也不都是酸性氧化物 如Mn₂O₇、是酸性氧化物,却是金属氧化物;CO、NO₂、NO等都是非金属氧化物,但不是酸性氧化物 (2) 碱性氧化物都是金属氧化物,但金属氧化物不一定碱性氧化物。 如 Na₂O₂、Al₂O₃ 都不是碱性氧化物 (3)酸性氧化物都是酸酐,都含有相对应的含氧酸,但不一定都能与水反应。 如 SiO₂是H₂SiO₃ /H₄SiO₄的酸酐,但SiO₂不与水反应 (4)离子型氧化物都是强电解质,共价型氧化物都是非电解质 常见氧化物: 氧化锌,氧化镁,氧化铁,氧化钙,氧化铬,氧化铝(Al₂O₃)。编辑本段氧化物的制备
氧化物通常可以用金属直接燃烧(直接氧气氧化)法、还原法、热分解法等来制备。详见:氧化物的制备。编辑本段氧化物结构的分类
离子型氧化物
| 化学式类型 | 氧化物举例 |
| M2O | 碱金属的氧化物 |
| MO | BeO、MgO、CaO、SrO、BaO、CdO、VO、MnO、CoO、NiO |
| M2O3 | Al2O3、Sc2O3、Y2O3、Ln2O3(镧系金属氧化物) |
| MO2 | ThO2、CeO2、UO2、SnO2、PbO2、TiO2、VO2、MnO2、RuO2、WO2、MoO2 |
| MO3 | ReO3、WO3 |
| M3O4 | Fe3O4、Pb3O4、Mn3O4 |
共价型氧化物
| 结构类型 |
| 氧化物举例 |
| 非金属元素 | 简单分子氧化物 | H、F、Cl、Br、I、S、Se、N、P、As、C的氧化物 |

| 巨分子氧化物 | B、Si的氧化物 |
| 金属元素 | 18电子外壳离子的氧化物 | Ag2O、Cu2O |
| 18+2电子外壳离子的氧化物 | SnO、PbO |
| 8电子外壳、高电荷离子的氧化物 | Mn2O7 |
编辑本段氧化物的物理性质
在元素的特征氧化物中,所有短周期元素的氧化物都是无色的,而长周期中却有一些元素的氧化物是有颜色的,例如第四周期钾~锰特征氧化物的颜色呈如下变化:| K2O | CaO | Sc2O3 | TiO2 | V2O5 | CrO3 | Mn2O7 |
| 白 | 白 | 白 | 白 | 橙 | 暗红 | 绿紫 |
这是由于各阳离子具有相同的8电子构型,但随着正电荷的增加和半径的减小,它们对O(2-)离子的极化作用逐渐增强了,使得激发态和基态之间的能量差越来越小,因而能够吸收部分可见光而使集中于氧端的电子向金属一端迁移(这种电子迁移叫做电荷跃迁),它们的吸收谱带向长波方向移动,致使氧化物的颜色逐渐加深。在特征氧化物中显色的,还有第五周期的Cd、Ag、In、Sb、Te,第六周期的W、Re、Os、Hg、Tl、Pb、Bi,以及许多的镧系元素和锕系元素的氧化物。这些过渡元素氧化物之所以显色,有些是由于电荷跃迁引起的,有些则是由于d-d跃迁引起的,镧系和锕系元素的氧化物中,有颜色的现象更为普遍。例如,由d-d跃迁引起的Fe、Co、Ni氧化物的颜色变化为: | FeO | CoO | NiO | | | Fe2O3 | Co2O3 | Ni2O3 |
| 黑 | 灰绿 | 绿 | | | 红 | 褐 | 灰黑 |
由于大多数金属氧化物具有无限三维离子晶格,一部分非金属氧化物具有网状共价结构,所以相当多的氧化物都是难熔物质,其中BeO、MgO、CaO、Al2O3、ZrO2、HfO2和ThO2以及SiO2等都是极难熔的,它们的熔点一般在1800~3300K之间,因而是优良的高温陶瓷材料,对于那些以分子单元结构存在的氧化物,它们多半呈分子晶型,共价分子之间以较弱的vander Waals力(范德华力)相结合,因而它们的熔、沸点都比较低。其中,在常温下呈气态的占多数,例如CO、CO2、N2O、NO、N2O3、NO2、N2O5、SO2和ClO2等;呈液态的有Cl2O7、Mn2O7;呈固态的有RuO4和OsO4却极易熔化(熔点分别为298.6K和313.8K).编辑本段氧化物的化学性质
酸碱性
根据酸碱特性,氧化物可分成4类:酸性的、碱性的、两性的和中性的。 (1)酸性氧化物。溶于水呈酸性溶液或同碱发生中和反应的氧化物是酸性氧化物。例如: P4O10+6H2O→4H3PO4 SiO2+2NaOH—熔融→Na2SiO3+H2O Sb2O5+2NaOH+5H2O→2Na[Sb(OH)6] 大多数非金属共价型氧化物和某些电正性较弱的高氧化态金属的氧化物都是酸性的。 (2)碱性氧化物。溶于水呈碱性溶液或同酸发生中和反应的氧化物是碱性氧化物。例如: CaO+H2O→Ca(OH)2 Fe2O3+6HCl→2FeCl3+3H2O 大多数电正性元素的氧化物是碱性的。 (3)两性氧化物。同强酸作用成酸性,又同强碱作用呈酸性的氧化物是两性氧化物。例如: ZnO+2HCl→ZnCl2+H2O ZnO+2NaOH+H2O→Na2[Zn(OH)4] 靠近长周期表中非金属区的一些金属元素的氧化物易显两性。 (4)中性氧化物。既不与酸反应也不与碱反应的氧化物叫做中性氧化物。例如CO和N2O。 详见:氧化物的酸碱性。热稳定性
大部分氧化物具有很高的热稳定性,尤其是IIA和IVB族元素的氧化物、Li2O、Na2O、B2O3、Al2O3、元素氧化物的等当量标准生成焓
SiO2等,对热不稳定的氧化物较少,例如卤素的氧化物、N2O5、Ag2O、HgO等。短周期元素氧化物的稳定性从左至右递减,唯碱金属元素氧化物的稳定性较碱土金属为差,当我们考虑到M+离子之间的斥力而使M2O的晶格能较低时就不难理解这个“反常”现象了;在同一族里,尤其是副族元素,从上向下热稳定性增强,这是因为,虽然从上向下随着阳离子和阴离子半径之和的增加而减小了晶格能,但随原子半径的增大而减小电离能的效应更为显著,特别是当阳离子的半径比氧离子的半径小时更是这样。 元素氧化物的等当量标准生成焓如有图。编辑本段常见的氧化物简表
(按元素周期表顺序) H₂O、H₂O₂、HO₂ He Li₂O BeO B₂O₃、B6O CO₂、CO、C₃O₂、C₂O、C₂O₃ N₂O、NO、N₂O₃、NO₂、N₂O₄、N₂O₅ OF₂、O₂F₂ Ne Na₂O、Na₂O₂、NaO₂ MgO Al₂O₃ SiO₂、SiO P₄O10、P₄O6 SO₂、SO₃ Cl₂O、ClO₂、Cl₂O₇ Ar K₂O、K₂O₂、KO₂、KO₃ CaO、CaO₂ Sc₂O₃ TiO₂ V₂O₅、VO₂、V₂O₃、VO CrO₃、CrO₂、Cr₂O₃ Mn₂O₇、MnO₂、MnO Fe₂O₃、Fe₃O₄、FeO Co₂O₃、Co₃O₄、CoO Ni₂O₃、NiO CuO、Cu₂O ZnO Ga₂O₃ GeO₂ As₂O₃、As₂O₅ SeO₂、SeO₃ Br₂O Kr Rb₂O、Rb₂O₂、RbO₂ SrO、SrO₂ Y₂O₃ ZrO₂ Nb₂O₅、Nb₂O₃ MoO₃、MoO₂ Tc₂O₇、TcO₂ RuO₂、RuO₄ Rh₂O₃ PdO Ag₂O、AgO、Ag(I)Ag(III)O2 CdO In₂O₃ SnO₂ SnO Sb₂O₃、Sb₂O₅ TeO₂、TeO₃ I₂O₅、I₄O₉ XeO₃、XeO₄ Cs₂O、Cs₂O₂、CsO₂ BaO、BaO₂ HfO₂ Ta₂O₅ WO₃、WO₂、W₂O₃ ReO₃、Re₂O₇ OsO₄ IrO₂ PtO₂ Au₂O₃ HgO、HgO₂ Tl₂O₃、Tl₂O PbO、Pb₃O₄、PbO₂ Bi₂O₃、Bi₂O₅ PoO₂ At Rn Fr Ra Rf Db Sg Bh Hs Mt Ds (*) La₂O₃ Ce₂O₃ CeO₂ Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu (**) Pr6O11、Tb4O7 Ac2O3 ThO₂ Pa2O5 U₃O₈ UO₂ UO₃ Np Pu Am Cm Bk Cf Es Fm Md No Lr (**) PuO₂、AmO₂ Rg Cn (在本表中,没有在元素符号后加O的表示尚未制得氧化物或不存在氧化物,加*表示无数据,其氧化物可根据元素周期律来推,加**表示大多形成三价氧化物)词条图册更多图册- 扩展阅读:
- 开放分类:
- 化学,化合物,化学品,无机物,氧化物
爱华网本文地址 » http://www.aihuau.com/a/25101017/328620.html
更多阅读

教你判断新浪微博中奖是真的吗?——简介近年来诈骗分子利用新浪微博页面,利用微博留言进行诈骗,发布新浪微博中奖信息诱人上当,骗取“中奖费”的骗局越来越多。相信不少微博用户都收到了类似的私信或者评论。下面由我来教大家如何判断新

YY平台刷信誉是真的吗?本人亲身经历谈——简介现在网购非常流行,尤其是淘宝网,更是无人不知无人不晓。淘宝开商铺有一个规则,那就是卖家信誉越高,商品越靠前。因为这个,网上也滋生了不少靠刷信誉的朋友,而且类似的广告铺天盖地,最常见就是

全日制研究生和在职研究生的区别——简介如今很多有志之士都会考虑提升自己的学历,也期望学历的提升有助于今后工作待遇提高,于是部分已工作几年的人士想读在职研究生。不少人认为:在职研究生是花钱买文凭。事实真的是这样吗?另外:全日制
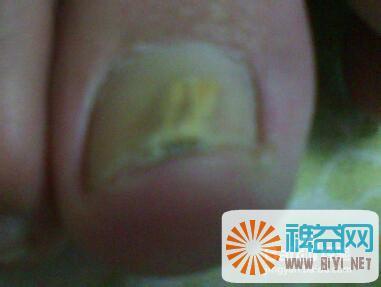
指甲变厚是怎么回事?有些有点变黄是灰指甲吗?——简介指甲是评判一个人卫生,精神风貌的第一要点;所以很多人的第一印象,往往因为指甲的问题而被破坏;比如说指甲变厚变黄;这是怎么回事呢?下面由皮肤科医生为大家介绍一下;指甲变厚是怎么回

网上赚钱是真的吗?——简介现在网上赚钱的宣传铺天盖地,让一些刚刚接触网赚的人很难分清真假。那么到底网上能不能赚到钱呢?小编结合自己的亲身经历给大家分析一下到底网赚可不可信,希望给刚刚接触网赚的朋友有所帮助。首先,虽然现在网

 爱华网
爱华网



