(1) 原电池的原理:较活泼的金属发生氧化反应,电子从较活泼的金属(负极)流向较不活泼的金属(正极)。这只是针对由活泼性不同的金属作电极而言,广义的原理应为:还原性较强的物质(负极)发生氧化反应,电子从还原性较强的物质通过外电路流向氧化性较强的物质(正极)。所以,可以利用原电池原理将其它的氧化还原反应设计成各种不同的电池(如燃料电池等)。
(2) 电极判断:利用氧化还原反应的原理判断正负极
负极:发生氧化反应(失电子的)电极,电极材料为还原性较强的物质
正极:发生还原反应(得电子)的电极,电极材料为氧化性较强的物质或惰性电极
但是,并不是所有作负极的电极都一定参加反应,而是氧化反应在其上面发生而已(如氢氧燃料电池),也并不是所有作正极的电极都不参与反应(如铅蓄电池),应当通过电池所发生的氧化还原反应进行具体分析。
(3) 电极反应的书写:
对于由活泼性不同的金属(或一种是非金属单质)构成的原电池的电极反应式较容易书写,而对于其它种类的氧化还原反应设计的电池则通常可由以下几个步骤分析书写:①分析氧化还原反应,确定氧化剂、还原剂及得失电子数目;②注意电解质溶液(介质),如负极与电解质溶液中离子反应,则正极生成相应离子;③合并两电极反应式后,消去得失电子数目及两边的介质离子,得到总的氧化还原反应的方程式。通常须灵活运用电荷守恒,原子守恒等原理。
例1(燃料电池)宇宙飞船上的氢氧燃料电池,其电池反应为:2H2+O2=2H2O,试写出电解质溶液为盐酸时的电极反应式,并指出各电极和介质溶液的pH的变化,若电解质溶液为KOH时又如何?
分析:在负极氢气失去电子,发生氧化反应;在正极氧气得到电子,发生还原反应。若消耗H+,则pH增大;若消耗OH-,则pH减小;若生成OH-,则pH增大;若生成H+,则pH减小。若稀释酸溶液,则pH增大;若稀释碱溶液,则pH减小。
答案:若电解质为盐酸时:
负极:2H2-4e—=4H+ pH变小
正极:O2+4H++4e—=2H2O pH变大
结论:溶液被稀释,pH变大。
若电解质为KOH时:
负极:2H2-4e—+4OH-=4H2O pH变小
正极:O2+2H2O+4e=4OH- pH变大
结论:溶液被稀释,pH变小。
例2(铅蓄电池)铅蓄电池其电极分别是Pb、PbO2,电解质是一定浓度的硫酸,工作时的反应方程式为:PbO2+Pb+2H2SO4=2PbSO4+2H2O试分别写出其电极反应式。请写出放电时的电极反应。
分析:在负极Pb失去电子,发生氧化反应;在正极PbO2得到电子,发生还原反应。
答案:负极:Pb+SO42--2e=PbSO4
正极:PbO2+4H++SO42-+2e—=PbSO4+2H2O
例3(海水电池)1991年我国首创以铝-空气-海水电池作为能源的新型海水标志灯,以海水为电解质,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水中数分钟,就会发出耀眼的白光,则电源负极材料为:,正极材料为: 。正、负极反应分别为: 、 。
分析:根据原电池构成的条件,活泼金属作负极(失去电子),发生氧化反应;惰性材料作正极(得到电子),发生还原反应。
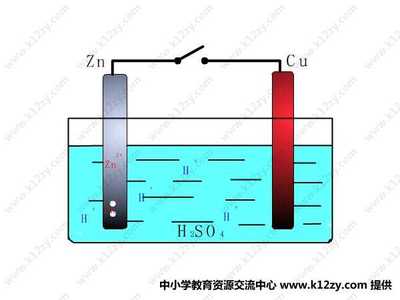
答案:负极材料为:Al;正极材料为:石墨等能导电的惰性材料或活泼性比铝弱的金属材料。
负极反应:3Al-12e—=3Al3+
正极反应:3O2+6H2O+12e—=12OH-
 爱华网
爱华网