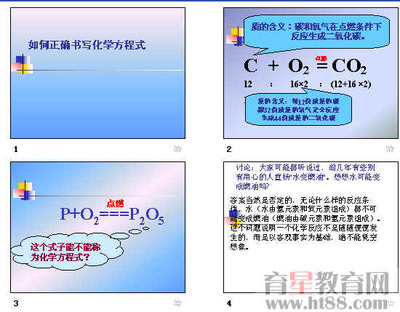
(一)化合反应
1.定义:多变一(2)基本形式:A+B=AB
2C+O2===2CO 2CO+O2===2CO2 CO2+C===2CO CO2+H2O==H2CO3
2.镁在空气中燃烧:
2Mg + O2点燃2MgO
现象:(1)发出耀眼的白光(2)放出热量(3)生成白色粉末
3.铁在氧气中燃烧:3Fe + 2O2点燃Fe3O4
现象:(1)剧烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体
注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底。
4.铜在空气中受热:2Cu + O2△2CuO现象:铜丝变黑。
5.铝在空气中燃烧:4Al +3O2点燃2Al2O3
现象:发出耀眼的白光,放热,有白色固体生成。
6.氢气中空气中燃烧:2H2 +O2点燃2H2O
现象:(1)产生淡蓝色火焰(2)放出热量(3)烧杯内壁出现水雾。
7.红(白)磷在空气中燃烧:4P +5O2点燃2P2O5
现象:(1)发出白光(2)放出热量(3)生成大量白烟。
8.硫粉在空气中燃烧: S + O2点燃SO2现象:
A.在纯的氧气中
发出明亮的蓝紫火焰,放出热量,生成一种有刺激性气味的气体。
B.在空气中燃烧
(1)发出淡蓝色火焰(2)放出热量(3)生成一种有刺激性气味的气体。
9.碳在氧气中充分燃烧:C + O2点燃CO2
现象:(1)发出白光(2)放出热量(3)澄清石灰水变浑浊
10.碳在氧气中不充分燃烧:2C + O2点燃2CO
11.二氧化碳通过灼热碳层: C + CO2高温2CO(是吸热的反应)
(二)分解反应
1.定义:一变多
基本形式:AB=A+B 2HgO===2Hg+O2
2.水在直流电的作用下分解:2H2O通电2H2↑+ O2↑
现象:(1)电极上有气泡产生。H2:O2=2:1
正极产生的气体能使带火星的木条复燃。
负极产生的气体能在空气中燃烧,产生淡蓝色火焰
3.加热碱式碳酸铜:Cu2(OH)2CO3△2CuO + H2O +CO2↑
现象:绿色粉末变成黑色,试管内壁有水珠生成,澄清石灰水变浑浊。
4.加热氯酸钾(有少量的二氧化锰):2KClO3△MnO2 2KCl + 3O2↑
5.加热高锰酸钾:2KMnO4△K2MnO4 +MnO2 + O2↑
6.实验室用双氧水制氧气:2H2O2MnO22H2O+O2↑
现象:有气泡产生,带火星的木条复燃。
7.加热氧化汞:2HgO△2Hg + O2↑
8.锻烧石灰石:CaCO3高温CaO+CO2↑(二氧化碳工业制法)
9.碳酸不稳定而分解:H2CO3 === H2O +CO2↑
现象:石蕊试液由红色变成紫色。
10.硫酸铜晶体受热分解:CuSO4•5H2O△CuSO4+ 5H2O
(三)置换反应
1.定义:一换一
基本形式:A+BC=AC+B
酸与金属反应:Zn+H2SO4==ZnSO4+H2↑ Fe+H2SO4==FeSO4+H2↑ Mg+2HCl==MgCl2+H2↑
盐与金属反应:2Al+3CuSO4==Al2(SO4)3+3CuCuSO4+Zn==ZnSO4+Cu
2.金属单质 + 酸—— 盐 + 氢气 (置换反应)
(1)锌和稀硫酸反应:Zn + H2SO4 === ZnSO4+ H2↑
(2)镁和稀硫酸反应:Mg + H2SO4 === MgSO4+ H2↑
(3)铝和稀硫酸反应:2Al + 3H2SO4 ===Al2(SO4)3 + 3H2↑
(4)锌和稀盐酸反应:Zn + 2HCl === ZnCl2 + H2↑
(5)镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑
(6)铝和稀盐酸反应:2Al + 6HCl === 2AlCl3 +3H2↑
(1)-(6)的现象:有气泡产生。
(7)铁和稀盐酸反应:Fe + 2HCl === FeCl2 + H2↑
(8)铁和稀硫酸反应:Fe + H2SO4 === FeSO4+ H2↑
(7)-(8)的现象:有气泡产生,溶液由无色变成浅绿色。)
3.金属单质 + 盐(溶液)——另一种金属 + 另一种盐
(1)铁与硫酸铜反应:Fe+CuSO4==Cu+FeSO4
现象:铁条表面覆盖一层红色的物质,溶液由蓝色变成浅绿色。
(古代湿法制铜及“曾青得铁则化铜”指的是此反应)
(2)锌片放入硫酸铜溶液中:CuSO4+Zn==ZnSO4+Cu
现象:锌片表面覆盖一层红色的物质,溶液由蓝色变成无色。
(3)铜片放入硝酸银溶液中:2AgNO3+Cu==Cu(NO3)2+2Ag
现象:铜片表面覆盖一层银白色的物质,溶液由无色变成蓝色。
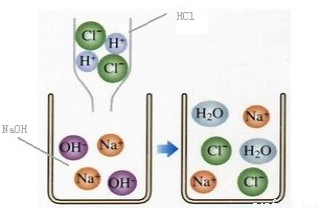
4.金属氧化物+木炭或氢气→金属+二氧化碳或水
(1)焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑
(2)木炭还原氧化铜:C+ 2CuO高温2Cu + CO2↑
现象:黑色粉未变成红色,澄清石灰水变浑浊。
(3)氢气还原氧化铜:H2 + CuO △Cu +H2O
现象:黑色粉末变成红色,试管内壁有水珠生成
(4)镁和氧化铜反应:Mg+CuO△Cu+MgO
(5)氢气与氧化铁反应:Fe2O3+3H2△2Fe+3H2O
(6)水蒸气通过灼热碳层:H2O + C高温H2 + CO
(四)复分解反应
1.定义:相互交换(正价与正价交换)
基本形式:AB+CD=AD+CB
实例
(1)酸与碱反应:
Ca(OH)2+2HCl==CaCl2+2H2ONaOH+HCl==NaCl+H2O2NaOH+H2SO4==Na2SO4+2H2O
(2)酸与盐反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑
(3)碱(可溶)与盐(可溶)反应:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH
(4)盐(可溶)与盐(可溶)反应:
CaCl2+Na2CO3==CaCO3↓+2NaClNa2SO4+BaCl2==BaSO4↓+2NaCl
复分解反应的条件:满足下列任意一个条件(1)有水生成 (2)有气体生成 (3)有沉淀生成
2.碱性氧化物+酸→盐+H2O
Fe2O3+6HCl==2FeCl3+3H2OFe2O3+3H2SO4==Fe2(SO4)3+3H2O
CuO+H2SO4==CuSO4+H2OZnO+2HNO3==Zn(NO3)3+H2O
3.碱+酸→盐+H2O
Cu(OH)2+2HCl==CuCl2+2H2OCu(OH)2+H2SO4==CuSO4+2H2O
NaOH+HCl==NaCl+H2O2NaOH+H2SO4==Na2SO4+2H2O
NaOH+HNO3==NaNO3+H2OMg(OH)2+2HNO3==Mg(NO3)2+2H2O
Ba(OH)2+H2SO4==BaSO4↓+2H2O
4.酸+盐→新盐+新酸
CaCO3+2HCl==CaCl2+H2O+CO2↑Na2CO3+2HCl==2NaCl+H2O+CO2↑
HCl+AgNO3==AgCl↓+HNO3H2SO4+BaCl2==BaSO4↓+2HCl
Ba(NO3)2+H2SO4==BaSO4↓+2HNO3NaHCO3+HCl==NaCl+H2O+CO2↑
5.盐1+盐2→新盐1+新盐2
KCl+AgNO3==AgCl↓+KNO3NaCl+AgNO3==AgCl↓+NaNO3
Na2SO4+BaCl2==BaSO4↓+2NaClBaCl2+2AgNO3==2AgCl↓+Ba(NO3)2
6.盐+碱→新盐+新碱
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4FeCl3+3NaOH==Fe(OH)3↓+3NaCl
Ca(OH)2+Na2CO3==CaCO3↓+2NaOHNaOH+NH4Cl==NaCl+NH3↑+H2O
(五)其他反应
1.一氧化碳在氧气中燃烧:2CO + O2点燃2CO2
现象:发出蓝色的火焰,放热,澄清石灰水变浑浊。
2.二氧化碳和水反应(二氧化碳通入紫色石蕊试液):
CO2 + H2O ===H2CO3 现象:石蕊试液由紫色变成红色。
注意:酸性氧化物+水→酸
如:SO2 + H2O ===H2SO3SO3 + H2O === H2SO4
3.生石灰溶于水:CaO + H2O ===Ca(OH)2(此反应放出热量)
注意:碱性氧化物+水→碱
氧化钠溶于水:Na2O + H2O =2NaOH
氧化钾溶于水:K2O + H2O=2KOH
氧化钡溶于水:BaO + H2O ==== Ba(OH)2
4.钠在氯气中燃烧:2Na +Cl2点燃2NaCl
5.无水硫酸铜作干燥剂:CuSO4 + 5H2O ====CuSO4•5H2O
6.二氧化碳通入澄清石灰水:
CO2 +Ca(OH)2 ==CaCO3↓+H2O现象:澄清石灰水变浑浊。
(用澄清石灰水可以检验CO2,也可以用CO2检验石灰水)
7.氢氧化钙和二氧化硫反应:SO2 +Ca(OH)2==CaSO3+ H2O
8.氢氧化钙和三氧化硫反应:SO3 +Ca(OH)2==CaSO4+ H2O
9.氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 ====Na2CO3 + H2O
10.氢氧化钠和二氧化硫反应(除去二氧化硫):2NaOH + SO2 ====Na2SO3 + H2O
11.氢氧化钠和三氧化硫反应(除去三氧化硫):2NaOH + SO3 ====Na2SO4 + H2O
注意:6-11都是:酸性氧化物 +碱 ——盐 + 水
12.甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O
现象:发出明亮的蓝色火焰,烧杯内壁有水珠,澄清石灰水变浑浊。
13.酒精在空气中燃烧:C2H5OH +3O2点燃2CO2 + 3H2O
现象:发出蓝色火焰,烧杯内壁有水珠,澄清石灰水变浑浊。
14.一氧化碳还原氧化铜:CO+ CuO 加热Cu +CO2
现象:黑色粉未变成红色,澄清石灰水变浑浊。
15.一氧化碳还原氧化铁:3CO+ Fe2O3高温2Fe + 3CO2
现象:红色粉未变成黑色,澄清石灰水变浑浊。(冶炼铁的主要反应原理)
16.一氧化碳还原氧化亚铁:FeO+CO高温Fe+CO2
17.一氧化碳还原四氧化三铁:Fe3O4+4CO高温3Fe+4CO2
18.光合作用:6CO2 +6H2O光照C6H12O6+6O2
19.葡萄糖的氧化:C6H12O6+6O2点燃6CO2+ 6H2O
 爱华网
爱华网