2016即将来到,在接下来的化学会考中,有关实验的知识点将是重点考试内容。下面是小编为您整理的九年级化学期末知识点复习。希望对各位有所帮助。
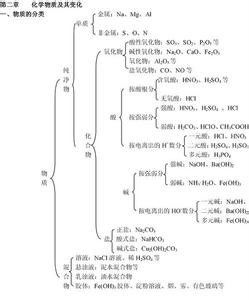
九年级化学期末知识点复习(一)一、怎样计算结晶水合物的相对分子质量?
在计算结晶水合物的相对分子质量时,要注意化学式的“·”不是数学上的“乘号”,而是表示结晶水合物里含有一定量的结晶水,其结晶水合物的相对分子质量是无水物的相对分子质量与结晶水的相对分子质量相加而不是相乘,如Na2CO3·10H2O的相对分子质量是Na2CO3的相对分子质量跟10H2O的相对分子质量相加的和,即Na2CO3·10H2O的相对分子质量23×2+12+16×3+18×10=286.
二、结晶水合物中通常含有两种或多种微粒,那么硫酸铜晶体究竟是纯净物还是混合物?
判断纯净物与混合物的依据是看该物质的组成(或构成)是否固定,而不是看该物质中所含微粒的种数,硫酸铜晶体的化学式为CuSO4·5H2O,即该晶体中CuSO4微粒与H2O分子之间的个数比是固定的,为1∶5,所以硫酸铜晶体中各元素之间的质量比是固定的.由此可知硫酸铜晶体是纯净物,类似的碳酸钠晶体也是纯净物.
三、将硫酸铜晶体加热变成无水硫酸铜是物理变化还是化学变化?这一变化是否可称作风化?
将硫酸铜晶体加热变成无水硫酸铜是化学变化,这个变化是由一种物质(胆矾)生成两种或两种以上其它物质(无水硫酸铜和水)的反应,所以属于分解反应.
风化是指室温和干燥的空气里,结晶水合物失去一部分或全部结晶水的现象,将胆矾变成无水硫酸铜,是在加热的条件下发生的,所以不是风化.
九年级化学期末知识点复习(二)1.怎样保存氢氧化钠和氢氧化钙?怎样检验久置的氢氧化钠、氢氧化钙是否变质?
固体氢氧化钠吸湿性特强,易吸收空气中的水分而潮解,而且还能跟空气中的二氧化碳起反应生成碳酸钠而变质;氢氧化钙虽不像氢氧化钠那样潮解,但也有吸湿性,同时也容易与空气中的二氧化碳反应生成碳酸钙,所以氢氧化钠、氢氧化钙都必须密封保存.
不仅固态的氢氧化钠、氢氧化钙需密封保存,而且它们的水溶液由于容易吸收空气中的二氧化碳也必须密封保存.
久置的氢氧化钠、氢氧化钙,往往因吸收了空气中的二氧化碳,部分变质为碳酸钠、碳酸钙,要检验它们是否变质,只要加一些稀盐酸即可.如果有气体产生表示已变质,否则未变质.
2.在应用碱的通性时要注意哪些问题?
课本上归纳的碱的通性有四条,这四条通性只是一般规律,在具体应用时必须考虑它们的适用范围和条件,现分述如下:
(1)碱溶液能跟酸碱指示剂起反应,此条通性指的是能溶解于水形成碱溶液的碱,因为能使酸碱指示剂变色的是溶液中的OH-.若将不溶性碱〔如Mg(OH)2、Cu(OH)2、Fe(OH)3等〕置于水中,由于它们的溶解度很小,在水中不能形成具有大量OH-的碱溶液,所以不能使酸碱指示剂改变颜色.
(2)碱+酸性氧化物→盐+水,此类反应需要满足的条件是:
①参加反应的碱必须是强碱(或可溶性碱),常用的可溶性碱有NaOH、KOH、Ba(OH)2、Ca(OH)2等.
②大多数非金属氧化物是酸性氧化物,如:SO3、SO2、CO2、SiO2等,还有少数不与碱反应的非金属氧化物,如CO、NO等不是酸性氧化物.
(3)碱+酸→盐+水,此类反应必须满足参加反应的碱和酸中,至少有一种是可溶性的.
(4)碱+盐→另一种盐+另一种碱,此条通性需满足两个条件:
①参加反应的碱和盐都必须是可溶性的.
②生成物中至少有一种是沉淀或气体,如:
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
Ba(OH)2+(NH4)2SO4=BaSO4↓+2H2O+2NH3↑
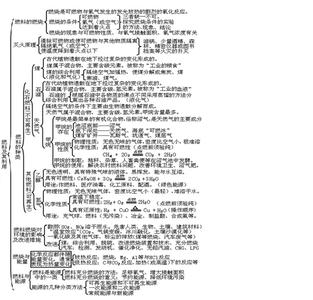
九年级化学期末知识点复习(三)一、认识燃烧、缓慢氧化和爆炸的条件及防火、灭火、防爆炸的措施
(1)燃烧的条件及可燃物燃烧的条件; (2)缓慢氧化的条件(3)爆炸发生的条件;
(4)防火灭火的原理和方法; (5)防爆炸的措施(列举实例)
二、实验探究燃烧的条件
(1)与氧气接触,温度达不到着火点;(2)温度达到着火点,不与氧气接触;(3)两者皆满足
三、控制变量法证明的必要条件,例:A、B、C三个条件;
具备B、C,不具备A,不成立,说明A是必要的;具备A、C,不具备B,不成立,说明B是必要的;
具备B、A,不具备C,不成立,说明C是必要的;
同时具备A、B、C,成立,说明ABC同时具备时,结论就可以成立;例:铁生锈,铜生锈;
四、燃料有关问题
石油的几种产品及主要用途(汽油、柴油、液化石油气等);知道石油是由沸点不同的有机物组成的混合物;了解我国能源和资源短缺的国情;知道化石燃料是人类重要的自然资源;形成?利用?主要组成元素?所属物质类别?了解使用H2、CH4、C2H5OH、液化石油气、汽油、煤等燃料对环境的影响?懂得选择对环境污染较小的燃料;认识新能源开发的重要意义。
 爱华网
爱华网