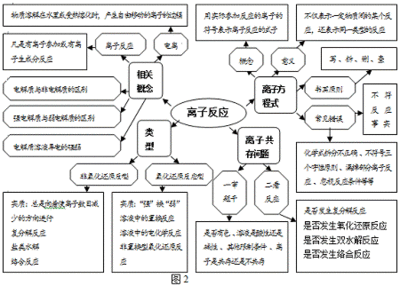
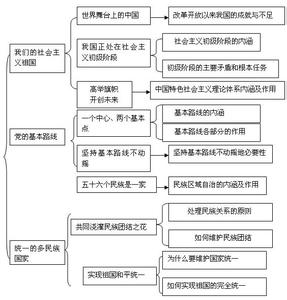
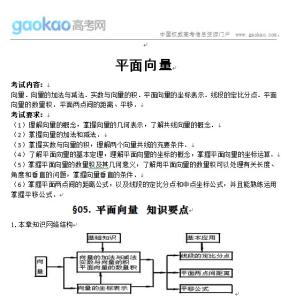
实验是化学学科的重要组成部分,这其中的知识点更是重中之重。下面是小编为您带来的高考化学必考实验知识点,希望对大家有所帮助。
高考化学必考实验知识点(一)1.中学阶段使用温度计的实验:
①溶解度的测定;②实验室制乙烯;③石油分馏。前二者要浸入溶液内。
2.中学阶段使用水浴加热的实验:
①溶解度的测定(要用温度计);②银镜反应.③酯的水解。
3.玻璃棒的用途:
①搅拌;②引流;③引发反应:Fe浴S粉的混合物放在石棉网上,用在酒精灯上烧至红热的玻璃棒引发二者反应;④转移固体;⑤醼取溶液;⑥粘取试纸。
4.由于空气中CO2的作用而变质的物质:
生石灰、NaOH、Ca(OH)2溶液、Ba(OH)2溶液、NaAlO2溶液、水玻璃、碱石灰、漂白粉、苯酚钠溶液、Na2O、Na2O2;
5.由于空气中H2O的作用而变质的物质:
浓H2SO4、P2O5、硅胶、CaCl2、碱石灰等干燥剂、浓H3PO4、无水硫酸铜、CaC2、面碱、NaOH固体、生石灰;
6.由于空气中O2的氧化作用而变质的物质:
钠、钾、白磷和红磷、NO、天然橡胶、苯酚、-2价硫(氢硫酸或硫化物水溶液)、+4价硫(SO2水溶液或亚硫酸盐)、亚铁盐溶液、Fe(OH)2。
7.由于挥发或自身分解作用而变质的:
AgNO3、浓HNO3、H¬2O2、液溴、浓氨水、浓HCl、Cu(OH)2。
8.加热试管时,应先均匀加热后局部加热。
9.用排水法收集气体时,先拿出导管后撤酒精灯。
10.制取气体时,先检验气密性后装药品。
高考化学必考实验知识点(二)一、常考20种气体:H2、N2、O2、Cl2、O3、HCl、HF、CO、NO、CO2、SO2、NO2、N2O4、H2S、NH3、CH4、C2H4、C2H2、CH3Cl、HCHO。
我们一定要弄清楚每种气体的基本性质(物理和化学),还有掌握一些气体之间相互转化的条件和化学方程式。
二、容易写错的20个字(词组):酯化、氨基、羰基、醛基、羧基、苯酚、铵离子、三角锥、萃取、过滤、蘸取、砷、锑、硒、碲、坩埚、研钵。
一字一分或者两分,可不要小看这一分两分,那可是决定你命运的数字!
三、有色物质
黑色:C、CuO、MnO2、FeO、Fe3O4
黄色:Na2O2、S、AgI、AgBr(浅黄)
红色:红磷、Cu2O、Cu、NO2(g)、Br2(g)、Fe(SCN)3(血红色)
蓝色:Cu(OH)2、CuSO4·5H2O
绿色:Cu2(OH)2CO3、CuCl2溶液、Fe2+、Cl2(黄绿色)
特殊颜色就是特殊信号,记准他,化学实验题就是给你送分来了。
四、化学实验中的“先”与“后”10例
(1)用H2还原CuO时,先通H2,后加热CuO,反应完毕后先撤酒精灯,冷却后再停止通H2。
(2)稀释浓硫酸时,烧杯中先装一定量蒸馏水后再沿器壁缓慢注入浓硫酸。
(3)做氯气的制备等实验时,先滴加液体后点燃酒精灯。
(4)检验SO42-时先用盐酸酸化,后加BaCl2。
(5)检验NH3(用红色石蕊试纸)、Cl2(用淀粉KI试纸)等气体时,先用蒸馏水润湿试纸后再与气体接触。
(6)中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后再移取液体;滴定管读数时先等1~2分钟后读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点。
(7)做气体的体积测定实验时先冷却至室温后测量体积,测量时先保证左右装置液面高度一致后测定。
(8)配制Fe2+、Sn2+等易水解、易被氧化的盐溶液,先把蒸馏水煮沸,再溶解,并加少量相应金属粉末和相应酸。
(9)检验卤代烃中的卤元素时,在水解后的溶液中先加稀HNO3再加AgNO3溶液。
(10)检验蔗糖、淀粉等是否水解时,先在水解后溶液中加NaOH溶液中和,后加银氨溶液或Cu(OH)2悬浊液。
五、气体干燥剂
常用的气体干燥剂按酸碱性可分为三类:
(1)酸性干燥剂,如浓硫酸、五氧化二磷、硅胶。酸性干燥剂能够干燥显酸性或中性的气体,如CO2、SO2、NO2、HCI、H2、Cl2 、O2、CH4等气体。
(2)碱性干燥剂,如生石灰、碱石灰、固体NaOH。碱性干燥剂可以用来干燥显碱性或中性的气体,如NH3、H2、O2、CH4等气体。
(3)中性干燥剂,如无水氯化钙等,可以干燥中性、酸性、碱性气体,如O2、H2、CH4等。
在选用干燥剂时,显碱性的气体不能选用酸性干燥剂,显酸性的气体不能选用碱性干燥剂。有还原性的气体不能选用有氧化性的干燥剂。能与气体反应的物质不能选作干燥剂,如不能用CaCI2来干燥NH3(因生成 CaCl2?8NH3),不能用浓 H2SO4干燥 NH3、H2S、HBr、HI等。
六、化学方法分离和提纯物质
(1)用化学方法分离和提纯物质时要注意:
①最好不引入新的杂质
②不能损耗或减少被提纯物质的质量
③实验操作要简便,不能繁杂。用化学方法除去溶液中的杂质时,要使被分离的物质或离子尽可能除净,需要加入过量的分离试剂,在多步分离过程中,后加的试剂应能够把前面所加入的无关物质或离子除去。
(2)对于无机物溶液常用下列方法进行分离和提纯:
1.生成沉淀法 例如NaCl溶液里混有少量的MgCl2杂质,可加入过量的NaOH溶液,使Mg2+离子转化为Mg(OH)2沉淀(但引入新的杂质OH-),过滤除去Mg(OH)2,然后加入适量盐酸,调节pH为中性。
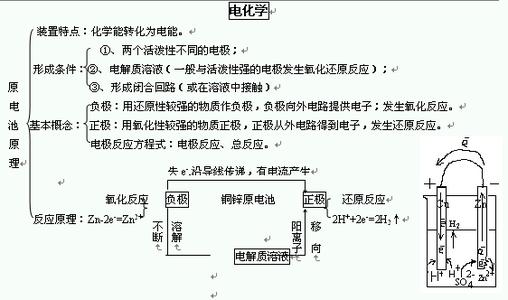
2.生成气体法 例如Na2SO4溶液中混有少量Na2CO3,为了不引入新的杂质并增加SO42-,可加入适量的稀H2SO4,将CO32-转化为CO2气体而除去。
3.氧化还原法 例如在 FeCl3溶液里含有少量 FeCl2杂质,可通入适量的Cl2气将FeCl2氧化为FeCl3。若在 FeCl2溶液里含有少量 FeCl3,可加入适量的铁粉而将其除去。
4.正盐和与酸式盐相互转化法 例如在Na2CO3固体中含有少量NaHCO3杂质,可将固体加热,使NaHCO3分解生成Na2CO3,而除去杂质。若在NaHCO3溶液中混有少量Na2CO3杂质,可向溶液里通入足量CO2,使Na2CO3转化为NaHCO3。
5.利用物质的两性除去杂质 例如在Fe2O3里混有少量的Al2O3杂质,可利用Al2O3是两性氧化物,能与强碱溶液反应,往试样里加入足量的 NaOH溶液,使其中 Al2O3转化为可溶性 NaAlO2,然后过滤,洗涤难溶物,即为纯净的Fe2O3。
6.离子交换法 例如用磺化煤(NaR)做阳离子交换剂,与硬水里的Ca2+、Mg2+进行交换,而使硬水软化。
高考化学必考实验知识点(三)1.白磷:保存在水中,防氧化,放冷暗处。镊子取,立即放入水中用长柄小刀切取,滤纸吸干水分。
2.液Br2:有毒易挥发,盛于磨口的细口瓶中,并用水封。瓶盖严密。
3.I2:易升华,且具有强烈刺激性气味,应保存在用蜡封好的瓶中,放置低温处。
4.浓HNO3,AgNO3:见光易分解,应保存在棕色瓶中,放在低温避光处。
5.固体烧碱:易潮解,应用易于密封的干燥大口瓶保存。瓶口用橡胶塞塞严或用塑料盖盖紧。
6.NH3,H2O:易挥发,应密封放低温处,不能用金属器皿盛放氨水。
7.C6H6、、C6H5-CH3、CH3CH2OH、CH3CH2OCH2CH3:易挥发、易燃,应密封存放低温处,并远离火源及强氧化剂。
8.卤水、石灰水、银氨溶液、Cu(OH)2悬浊液等,都要随配随用,不能长时间放置。
9.滴定管最上面的刻度是0。小数点为两位
10.量筒最下面的刻度是0。小数点为一位。
 爱华网
爱华网