由于上一篇有关化学学习的文章,有一位孩子叫杨泽民的家长看到我文章后面的微信号后,在微信上问我:“老师!我刚才看了你写的文章,我觉得您说得很有道理,我也替孩子收藏了。可是说的有点过于抽象了,这次能不能具体说说,化学的学习方法呢?”
可能我上一篇文章赶的比较着急,因为紧接着就有一堂课要备课。这次为了弥补遗憾,我将具体如何学习化学,总结如下:
第一 重视实验课程
在化学书中有很多有趣的化学实验,我身边很多和我同时代的优秀人才,就是做化学实验,才爱上化学,以至于到后面的大学专业也选择和化学有关。
化学实验是人类研究物质的基本变化规律的一种有效的科学方法,在初中课程中,一共有82个实验,而很多中考题都和这82个实验有关。如果孩子觉得实验有趣,那么必然会激发他们掌握大量的化学知识,以供给他们下一次的实验理论需求。
化学试验可以获得化学知识、锻炼学生实验思维和解决问题的能力,更重要的是帮助学生巩固和复习化学知识,更深入得理解化学课本中的知识,认真填写化学试验。
第二 除了背还是背
初中化学知识点零散,比较难记忆,涉及到元素符号、化合价、化学方程式等内容。我的很多学生反映化学好学,就是不好记。
这里就要引入我教授的记忆方法,可以先记忆容易的,再记忆困难的知识,氢H,氧O,碳C,氯Cl,钠Na,镁Mg,铝Al,氦He,氖Ne,硫S,剩下的化学符号可以放在后面再记忆。化学价就需要死记硬背了,但是可以编成顺口溜记忆:
一价钾、钠、氢和银,二价钙、镁、铜、钡、锌,铁,铝三价氯负一,氧、硫负二要记清。除了利用记忆方法来记忆,也可以通过做题查找资料记忆,在做题的过程中熟记和掌握记忆化学知识。
一定要灵活运用记忆方法:在学习“水的电解”实验时,正极产生氧气,负极产生氢气,对于这个实验现象同学们总是混淆,我们就用谐音“父亲”来记忆“负氢”。在学习“氢气还原氧化铜”实验时,我们用“氢气早出晚归,酒精灯迟到早退”来记忆实验的操作顺序。此外还可用图表记忆、对比记忆、数字记忆、规律记忆、浓缩记忆、联想记忆等方法,把枯燥的化学知识趣味化,这样就能记得清,记得牢。
应11位家长的需求,我这里找出几道中考必考化学题型,里面的知识点经常要考到,在做题时,先自己做一遍,再对答案,看解析。要把整个题型都研究透彻:
例1:现有Fe,稀H2SO4,CuCl2溶液,NaOH溶液,Fe2O3,两两混合后,能发生反应的有
A.7个 B.6个 C.5个 D.4个
分析:解答这类问题最容易遗漏能反应的,或将不能反应的物质也计算在内,避免发生这种错误的方法是“先分类,后碰球”。具体作法如下:
分类 单质 酸 盐 碱 金属氧化物
答案:应选C
例2:下列各组物质,能在溶液中共存的是
A.Ca(OH)2、HNO3、CaCl2 B.Ba(NO3)2、H2SO4、KNO3
C.K2SO4、CuCl2、NaOH D.NaCl、K2CO3、KOH
分析:所谓“共存”,就是指彼此之间不发生化学反应。本题中的各组物质,都是可溶性的酸、碱、盐,它们彼此之间是否发生复分解反应,关键要看有无沉淀、气体或水生成。A组溶液中的Ca(OH)2跟HNO3发生中和反应,有难电离的水生成,故不能共存。B组溶液中的Ba(NO3)2跟H2SO4能反应生成难溶的BaSO4白色沉淀,故不能共存。C组溶液中的CuCL2跟NaOH反应,生成难溶的Cu(OH)2,故不能共存。D组溶液中的三种物质间两两都不能发生反应,故能共存于溶液中。答案为D。
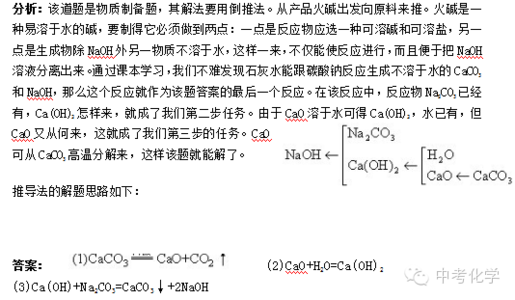
例3:在一定条件下,下列物质的转变不能一步完成的是
A.Na2CO3?CaCO3 B.Fe2O3?Fe
C.CaO?Ca(OH)2 D.CuO?Cu(OH)2
分析: A组中由Na2CO3 CaCO3
这是由可溶性的碳酸盐Na2CO3转化成不溶性的碳酸盐CaCO3的过程。只要选择可溶性的钙盐,或者可溶性的碱Ca(OH)2,利用盐和盐或盐和碱的复分解反应,就可以一步实现这种转化:
如:Na2CO3+CaCl2==2NaCl+CaCO3ˉ Na2CO3+Ca(OH)2==2NaOH+CaCO3ˉ
B组中Fe2O3?Fe
这是由金属氧化物转变成金属单质的过程。只要在一定条件下使用还原剂,就可以将Fe2O3转变成Fe单质。 常用的还原剂有H2、C、CO。
C组中CaO Ca(OH)2 D组中CuO?Cu(OH)2
这两组均是由碱性氧化物向对应的碱转化的过程。这种转化,只限于可溶性的碱KOH、NaOH、Ca(OH)2、Ba(OH)2对应的碱性氧化物K2O、Na2O、CaO、BaO能直接跟水化合生成碱。
如:CaO+H2O==Ca(OH)2大多数的碱性氧化物如CuO、Fe2O3等都不能直接跟水化合生成对应的碱。所以CuO向对应碱Cu(OH)2转变是不能一步完成的。如何由CuO制取难溶性的碱Cu(OH)2呢?一般地说,可用下列方法: CuO+H2SO4==CuSO4+H2O
CuSO4+2NaOH==Cu(OH)2ˉ+Na2SO4
例4:今有AgNO3溶液、BaCl2溶液、Ba(NO3)2溶液、Ba(OH)2溶液、Na2CO3溶液和Zn粉供选用。若欲除去稀硝酸中混有的少量硫酸,以得到纯净的稀硝酸,应加入适量 ,发生反应的化学方程式为
发生反应的化学方程式为 ,该反应的类型是 。
分析:为了有效地从溶液中除去溶解着的杂质,所加入的适量试剂通常要具备以下基本条件:一是跟要保留的溶质不反应;二是能跟杂质发生反应,该反应的产物,或是沉淀、气体从溶液中析出或逸出,或是生成水、或者变成提取物保留在溶液中,以有效地去掉杂质,且不引入新的杂质。
除去稀硝酸中的少量硫酸,实质是除去SO4离子。含Ba2+的溶液——Ba(NO3)2溶液、BaCl2溶液和Ba(OH)2溶液都能和H2SO4反应,并产生BaSO4沉淀。若使用Ba(NO3)2溶液,在生成BaSO4沉淀的同时产生HNO3,HNO3恰好是应保留的溶质,反应后过滤去掉BaSO4沉淀,即可得到纯净的稀硝酸。若改用BaCl2溶液,在生成BaSO4沉淀的同时产生HCl(易溶于水),从而引入了新杂质。若改用Ba(OH)2溶液,Ba(OH)2不仅与H2SO4反应,也与应保留的溶液HNO3反应,消耗了硝酸。可见,使用BaCl2溶液或Ba(OH)2溶液都不正确。
同样道理,除去NaCl溶液中的少量HCl,实质是除去过量H+。Ba(OH)2溶质、Na2CO3溶液、Zn粉末都能跟盐酸反应。若使用Zn或Ba(OH)2溶液,在消耗HCl的同时,产生可溶于水的ZnCl2或BaCl2,将向溶液中引入新的杂质。若使用适量Na2CO3溶液,在消耗HCl的同时,产生NaCl、H2O均不引入新杂质,产生的CO2气体从溶液中逸出,最终会得到纯净的NaCl溶液。
答案:Ba(NO3)2溶液, Ba(NO3)2+H2SO4=BaSO4ˉ+2HNO3
Na2CO3溶液, Na2CO3+2HCl=2NaCl+H2O+CO2- 复分解反应。
当然,我还有提升学习成绩的方法想要跟大家分享,由于内容过多,这里就不多说了。大家可以参加我的免费课程了解更多。如果你还为其它教育和学习方面的问题烦恼,也可以直接发微信与我交流。
那么请加微信:211588393 我致力于记忆力提升、中小学学习方法的研究,希望能在教育问题上对家长有所帮助。
 爱华网
爱华网