干细胞制剂制备质量管理自律规范
中国医药生物技术协会
第一章 总 则
第一条 为加强干细胞制剂制备质量管理的行业自律,避免干细胞制剂制备过程中污染、交
叉污染以及混淆、差错等风险,确保持续稳定地制备出符合质量标准和预定用途的干细胞制剂,参照国内外相关规定和指南,制定本规范。
第二条 干细胞制剂是指用于治疗疾病或改善健康状况的、以不同类型干细胞为主要成分、
符合相应质量及安全标准,且具有明确生物学效应的细胞制剂。
第三条 本规范适用于干细胞制剂制备的所有阶段。
第二章 一般要求
第四条 干细胞制剂的制备应遵循《药品生产质量管理规范》(GMP)的基本原则及其相关
规定以及其他适用的规范性文件。
第五条 干细胞制剂制备机构(以下简称制备机构)应建立符合 GMP 要求、完整的干细胞
制剂制备质量管理体系,并设立独立的质量管理部门,履行质量保证和质量控制的职责。
第六条 制备机构应根据每种干细胞制剂的特性及其制备工艺进行风险评估,并建立合理的
质量管理策略。
第七条 制备机构的工作区域应合理设计及布局。各功能区域应相对独立,应有满足其功能
需要的空间、设施、设备和洁净度要求。质量控制区应与制备区实施物理隔离,行政区、生活区及辅助区等应不防碍干细胞制剂的制备。
第八条 干细胞制剂制备的内、外环境应满足其质量保证和预定用途的要求,应严格控制微
生物、各种微粒和热原的污染风险。
第九条 干细胞制剂制备管理负责人、质量管理负责人和质量受权人应具有与职责相关的专
业知识(细胞生物学、微生物学、生物化学或医药等),同时应具有 5 年以上的相关工作经验或接受过相应的专业培训,应能够履行干细胞制剂制备或质量管理的职责。制备管理负责人与质量管理负责人、质量受权人不得相互兼任。
第十条 从事干细胞制剂制备、质量保证、质量控制及其他相关人员(包括清洁、维修人员、
物料仓储管理人员等 )均应根据其工作性质进行专业知识、安全防护、应急预案的培训和继续教育。制备机构应建立人员档案,包括卫生及健康档案。对直接进行制备和质控
操作的已离职员工档案,应至少保留 30 年。
第十一条 从事干细胞制剂制备的人员、质量控制人员、包装人员应及时记录并报告任何可
能导致污染的情况,包括污染的类型和程度。制备机构应采取严格的措施,避免体表有伤口、患有传染性疾病或其他可能污染干细胞制剂的人员从事制备、质量控制和包装的操作。
第十二条 应建立设备、仪器、设施的管理档案,并建立唯一的编码标识系统,确保其使用
情况的可追溯性,并对相关设备按照其说明书要求建立完善的使用及维护管理制度。 第十三条 与细胞制备、质量控制直接相关的仪器、设备,如灭菌柜、超净工作台、生物安
全柜、空气净化系统和工艺用水系统等,应经过验证或确认,经质量管理部门批准后方可使用,并进行计划性校验和维护。
第十四条 如采用电子信息系统进行管理,制备机构应建立电子信息系统的设计、运行、使
用、升级、变更等管理程序,并对其运行的准确性和完整性进行定期验证。
第三章 供者与采集
第十五条 制备机构应建立并执行干细胞供者评估标准,通过筛查既往病史、家族史、当前
健康报告,必要时还应包括出入疫区等其他情况的报告及样本检测(包括但不仅限于 HIV、HBV、HCV、HTLV、EBV、CMV、梅毒螺旋体等)进行干细胞供者的评估,以预防传染性疾病和明确的遗传性疾病通过干细胞制剂进行传播。
第十六条 有下列情况的人员不应作为异体干细胞制剂的供者:
(一)现病史或既往病史有严重传染性疾病;
(二)家族史有明确的遗传性疾病;
(三)未排除可能感染严重传染病(如近期出入过严重传染病疫区等),或其他不宜作为供者的情况。
第十七条 自体干细胞制剂的供者,应根据所制备干细胞制剂的来源、特性和预定用途,制
定合理的自体供者的评估标准和制备要求,并完成上述病原体筛查。
第十八条 如使用诱导的多能性干细胞作为干细胞的来源,应能追溯到体细胞的供者,应进
行供者评估所需的筛查和检测。
第十九条 如使用体外授精术产生的多余胚胎作为建立人类胚胎干细胞系的主要来源,应能
追溯配子的供者,应进行供者评估所需的筛查和检测。在使用多余胚胎前,应取得胚胎所有人的知情同意和授权,并经过伦理委员会批准。
第二十条 所有人源采集物的采集必须得到供者或其法定代表人、监护人的同意,并签署知
情同意书。
第二十一条 采集机构应是取得《医疗机构执业许可证》的具有供者筛查能力的医疗机构。
胚胎干细胞提供机构,必须是经国家相关部门批准的专业机构。制备机构应对采集机构
或提供机构的资质进行确认,并定期进行评估。
第二十二条 采集工作应由采集机构的医护人员实施。采集人员应持有医师或护士执业证书,
并经过相应的培训后方能进行采集。制备机构应向采集机构和采集人员明确采集物的质量标准、对采集信息和采集记录的要求、采集物发运前在采集场所的临时保存条件以及对采集物包装和发运的要求,必要时制备机构应对采集人员进行培训和指导。
第二十三条 采集机构应制定采集标准操作规程,并备有采集过程中的应急预案。采集过程
应严格执行标准操作规程并有真实记录,采集信息应双人复核。
第二十四条 采集过程应采取措施保护供者的健康和安全,并通过无菌技术操作最大限度降
低污染、感染和病原传播的风险。采集用的接触采集物的试剂和物料应无菌、符合临床安全标准,且在有效使用期内。需由制备机构提供的无菌试剂和物料,应经过制备机构质量控制部门的验证并合格。
第二十五条 采集机构应向制备机构提供采集物的获取方式、途径以及相关的临床资料,包
括但不限于供者的一般信息、既往病史、家族史和当前健康报告等。既往病史和家族史要对遗传性疾病相关信息进行详细收集,必要时应收集供者的 ABO 血型、HLA-I 类和 II 类分型资料及 DNA 样本以及过去三个月内出入疫区的情况报告,以备追溯性查询。采集机构和制备机构应建立供者个人隐私保护机制,确保个人信息受控。
第二十六条 应建立采集物的唯一标识系统,以配合后续的各个标识系统满足干细胞制剂的
可追溯性。
第四章 接收与制备
第一节 接 收
第二十七条 制备机构应制定并执行每一种采集物的质量标准和接收标准操作规程。应设置
采集物的接收取样工作区,执行采集物的登记、编号、初检、核对、取样和暂存功能。接收取样工作区应与制备区隔离并有独立的洁净环境,接收时的取样操作应在A级洁净环境下进行。
第二十八条 接收人员收到采集物时应对采集物登记并进行唯一识别编码,并准确填写交接
信息。
第二十九条 接收人员应对采集物进行初检,初检内容包括但不限于:
(一)采集物信息核对,包括名称、数量、重量、供者信息、健康调查、表单等;
(二)检查采集物内外包装及运输容器是否完整、密封状态等;
(三)目检采集物是否有变质、损坏或污染;
(四)取样并送检。
第三十条 采集物如有异常或特殊情况,接收人员应及时通知质量管理人员。制备机构应建
立采集物异常或特殊情况处置操作规程,进行无害化处理。
第三十一条 当采集物某些检测项目周期较长时,可先进行后续工艺操作,但应对细胞进行
有效的识别和隔离,待检验合格后方可对由该采集物制备的干细胞和干细胞制剂予以放行。
第二节 制 备
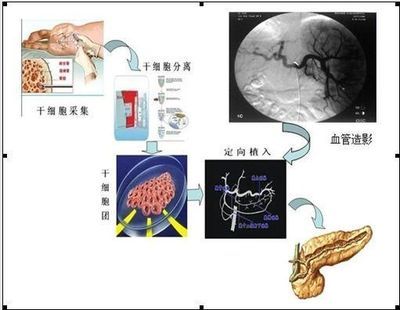
第三十二条 制备机构应对每种干细胞制剂制备的全过程,建立相应的工艺规程,包括干细
胞的富集、扩增、诱导、收获、冻存、分装等操作,并进行全面的工艺研究和验证。 第三十三条 干细胞制剂制备的工艺规程内容包括但不限于:
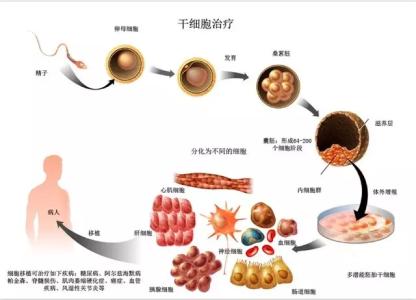
(一)细胞的富集、分离、纯化、扩增和传代、冻存、细胞系细胞库的建立、向功能性细胞定向分化;
(二)培养基、辅料和包材的选择标准及使用;
(三)细胞复苏、分装和标记,以及残留物去除;
(四)干细胞制剂成分及含量;
(五)干细胞制剂制备标准操作规程;
(六)过程质量控制点和中间制剂的质量标准;
(七)终制剂质量标准;
(八)包装标准操作规程。
第三十四条 应为干细胞制剂的制备设立专用和独立的制备区、制备设施和设备。应建立干
细胞制剂制备区、质量控制区和包装区的标识制度,包括但不限于工序标识、功能间/区标识、状态标识、警示标识、应急处置标识等。
第三十五条 应按照工艺规程设计相应操作区的洁净度级别,非完全密封状态下的细胞操作
(如分离、培养、灌装等)以及与细胞直接接触的无法终端灭菌的试剂和器具的操作,应在 B 级背景下的 A 级环境中进行。
第三十六条 应建立严格的清场操作规程和建立完整的洁净区环境监测操作规程,并对每项
监测指标制定相应的检测方法和频次。
第三十七条 应合理安排制备工序的操作区域,不同质量标准或者工艺规程的干细胞制剂应
在不同的房间操作;试剂的准备,干细胞的分离、扩增和诱导分化,干细胞制剂的配制和灌装或分装等操作,应在洁净区内分区域进行;不同批次的干细胞制剂不应同一时间在同一 A 级区域内操作。
第三十八条 干细胞制剂应严格按照经批准的重悬液的配方进行配制和灌装,应尽可能缩短
从细胞消化到制剂灌装的间隔时间。
第三十九条 根据干细胞的特性及制备工艺,应在工艺的不同阶段(包括细胞库)制定相应
的过程控制项目及质量标准,包括无菌、支原体、内外源病毒、细胞鉴别、细胞活力及生长特性、细胞纯度及均一性、细胞染色体核型、生物学效力、临床适应证特定指标、异常免疫学反应、内毒素及致瘤性等检测。
百度搜索“爱华网”,专业资料、生活学习,尽在爱华网!
 爱华网
爱华网