一、概念
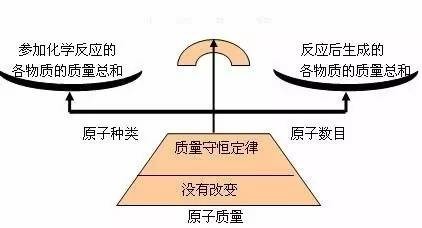
参加化学反应的各物质的质量总和等于反应后生成各物质的质量总和
解释:在一切化学反应中,反应前后原子的种类没有改变,原子的数目没有增减,原子的质量没有变化,所以化学反应前后各物质的质量总和必然相等。
实验验证:(1)白磷的燃烧;(2)Fe和CuSO4溶液的反应等
注意:有气体参加和生成的反应必须在密闭容器中进行。有充气的气球装置要考虑浮力因素,虽然反应前后质量相等,但在托盘天平上称量,反应后托盘天平并不平衡。
二、正确理解质量守恒定律要扣住关键词
(1)“化学反应”规定了研究范围,因而不能用来解释物理变化。即一切化学反应都遵循质量守恒定律。
(2)“参加”:不能把“参加反应的各物质”简单的理解为“反应物”因为化学反应中往往存在“某些物质的过量”问题,没有参加反应和反应后剩余的物质不能算。
(3)“各物质”:不能遗漏任何一个反应物和生成物,特别是气体和沉淀。
(4)“反应生成”:不是反应生成的物质不能算。
(5)“质量总和”:指各参加反应的物质的质量总和或生成物的质量总和。
另外,质量守恒定律只研究化学反应的质量问题,而颜色、体积、热量等的变化都不在研究范围内。
三、从“量”的角度来研究,可理解归纳为“三个守恒、两个一定改变、一个可能改变”
三个守恒:
(1)(宏观上)元素守恒:反应前后元素的种类和质量不变;

(2)(微观上)原子守恒:反应前后原子的种类、数目、质量都不变;
(3)(质量上)质量守恒:反应前的物质的总质量等于反应后的物质的总质量。
两个一定改变:
(1)宏观:物质的种类一定改变;
(2)微观:分子的种类一定改变。
一个可能改变:
分子的总数可能改变。
四、质量守恒定律的应用主要体现在以下几个方面
(1)解释反应前后物质质量的“增重”、“减轻”和“不变”现象,利用质量守恒定律来推断。
例1、铁丝燃烧后,生成物的质量比铁丝的质量大;高锰酸钾受热分解后,剩余固体的质量比反应物的质量减小。
解析:以上两个反应都遵循质量守恒定律,铁丝燃烧时,参加反应的反应物是铁和空气中的氧气,根据质量守恒定律,生成物的质量等于参加反应的铁和空气中的氧气质量总和,所以生成物的质量比铁丝的质量大。而高锰酸钾分解后,生成锰酸钾(固体)、二氧化锰(固体)和氧气。根据质量守恒定律,反应物高锰酸钾的质量应等于生成物锰酸钾、二氧化锰和氧气的质量之和,由于氧气逸出,所以剩余固体的质量比反应物的质量减小。
而将9g水变成9g水蒸气,这一变化前后虽然质量相等,但却是物理变化,不能说这一变化符合质量守恒定律。
(2)推断反应物或生成物的组成元素,利用元素守恒定律来推断。
例2、某化合物完全燃烧,需要9.6g氧气,同时生成8.8g CO2和5.4g水,则此化合物中( )
A、只含碳、氢两种元素 B、只含碳、氧两种元素
C、含碳、氢、氧三种元素 D、一定含碳、氢元素,可能含氧元素
解析:根据质量守恒定律可知:参加反应的化合物的质量为:8.8g+5.4g-9.6g=4.6g。
根据生成CO2和H2O的质量可以求出化合物中:m(C)=8.8g ××100%=2.4g,
m(H)=5.4g××100%=0.6g,m(C)+ m(H)=2.4g+0.6g=3g<4.6g,说明化合物中除了含有碳元素和氢元素外,还含有氧元素,故选C。
(3)推断某反应物和生成物的化学式、质量比等,利用原子守恒定律来推断。
例3、(2011年潍坊)“酒驾”已经写入刑法。人体血液中酒精含量超过20mg/l00mL为酒驾,酒精含量超过80mg/l00mL为醉驾。交警常用一种“酒精检测仪”检测司机是否酒后驾车。其反应原理为C2H6O+4CrO3+6H2SO4=2X+2CO2↑++9H2O,则X的化学式( )
A、Cr2O3 B、CrSO4 C、Cr2(SO4)3 D、Cr2S3
解析:根据化学反应前后原子的种类和数目没有改变,因此2X包括4个铬原子、6个硫原子和24个氧原子,又因为X的化学计量数为2,因此推出X的化学式为Cr2(SO4)3故答案选C。
(4)正确书写、配平化学方程式和判断化学方程式是否正确,利用原子守恒。(在化学式前面加上适当的化学计量数,使得左右两边各原子和个数相等。
(5)进行有关化学方程式的计算,利用质量守恒。
例4、(2010年黄冈)在一密闭容器内有氧气、二氧化碳、水蒸气和一种未知物W,在一定条件下充分反应,测得反应前后各物质的质量如下表所示,则下列说法错误的是( )
物质
氧气
二氧化碳
水蒸气
W
反应前质量/g
50
1
1
23
反应后质量/g
2
45
28
X
A、根据质量守恒定律,X的值为0 B、反应后的生成物是二氧化碳和水
C、物质W只含碳和氢两种元素 D、物质W一定含碳、氢、氧三种元素
解析:根据质量守恒定律:质量增加的是生成物,质量减少的是反应物,质量不变的物质可能没有参加反应,也可能是该反应的催化剂,由题意可知,O2的质量减少了48g,CO2的质量增加了44g,H2O的质量增加了27g,由质量守恒知,W的质量应减少23g,反应后W的质量为0g,W是反应物。该反应可用W + O2 → CO2 + H2O表示,由元素守恒推知,W中一定含有碳和氢元素,且m(C)=44g××100%=12g ,m(H)=27g××100%=3g,碳元素和氢元素的质量之和为12g+3g=15g<23g,所以W中一定还含有(23g-15g=8g)氧元素。故答案选C。
【链接中考】
1、下列现象不能用质量守恒解释的是( )
A、纸燃烧化为灰烬,灰烬的质量比纸的质量小
B、镁条燃烧生成物的质量比镁条的质量大
C、一杯水敞口放置一段时间后质量变小
D、蜡烛燃烧后质量减小
2、将a g氯酸钾和b g二氧化锰混合加热到质量不再减少,得到剩余固体的质量为c g,该反应生成氧气的质量为________g,同时生成氯化钾的质量为________g。
3、某化合物在纯氧中燃烧生成CO2和SO2,则此化合物中一定含有_______和_______两种元素,可能含有______元素。
4、(2012?湛江)如图是密闭体系中某反应的微观示意图,“”和“”分别表示微粒。
(1)反应前方框内应再填入1个________微粒(填字母)。
A、 B、 C、 D、
(2)该反应所属的基本反应类型是___________反应。
(3)写出符合该微观示意图的一个具体反应的化学方程式___________________。
5、3g某物质在氧气中燃烧生成了8.8g CO2和5.4g H2O,该物质的组成中( )
A、一定含C、H、O元素 B、一定含C、H元素,可能含O元素
C、只含C、H元素 D、无法判断
6、在一个密闭容器中,放入M、N、P、Q四种物质,在一定条件下发生化学反应。一段时间后,测得有关数据如下表,则关于此反应认识不正确的是( )
物质
M
N
Q
P
反应前质量/g
18
1
2
32
反应后质量/g
X
26
2
12
A、该变化的基本反应类型是分解反应
B、反应后物质M的质量为13g
C、反应中N、P的质量比为5:4
D、物质Q可能是该反应的催化剂
 爱华网
爱华网