新学期开始,初中化学的新课学习也已经接近尾声,教材第十和十一章学习的酸碱盐部分是初中化学知识体系中最核心的内容,它将初中化学中各类物质通过化学反应联系起来,所以也成为每年中考化学试题中的考查重点,是区分学生学习水平的一块“试金石”。对于“酸碱盐”的学习,大家普遍感觉知识多、题型广、难度大,掌握起来非常困难,特别是各类物质间的相互反应关系。现将各类物质之间的八大反应规律,按照反应类型进行逐一进行梳理,并以各类题型考查频率较高的经典反应为例,希望对同学们的学习有所帮助。
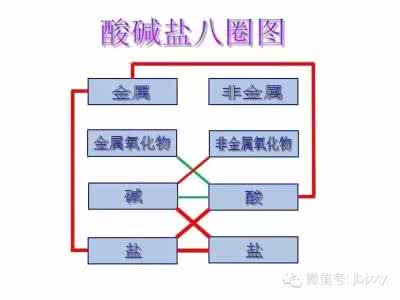
一、复分解反应(属于基本反应类型,共5个)
反应1:金属氧化物+酸→盐+H2O
说明:
a.初中常见的金属氧化物(Fe2O3、CuO、CaO、MgO)均能与酸反应
经典反应:
b.Fe2O3+3H2SO4=Fe2(SO4)3+3H2O(用稀硫酸除铁锈)
c.Fe2O3+6HCl=2FeCl3+3H2O(用稀盐酸除铁锈)
反应2:酸+碱 →盐+H2O
说明:
a.此反应又称为中和反应
b.无论碱是否可溶均可以与酸发生反应
经典反应:
c.Ba(OH)2+H2SO4=BaSO4↓+2H2O(初中唯一有沉淀生成的中和反应)
反应3:酸+盐→新酸+新盐
说明:
a.酸盐反应先看盐,碳酸盐遇强酸就出气,否则生成沉淀不怕酸
b.无论反应物中碳酸盐是否可溶均可以与酸发生反应生成二氧化碳气体
c.初中生成沉淀的酸盐反应共三个反应,且必须生成不溶于酸的BaSO4或AgCl沉淀
经典反应:
a.CaCO3+2HCl=CaCl2+H2O+CO2↑(实验室制CO2的原理)
b.Ba(NO3)2+H2SO4=BaSO4↓+2HNO3(生成沉淀的酸盐反应)
c.BaCl2+H2SO4=BaSO4↓+2HCl(生成沉淀的酸盐反应)
d.AgNO3+HCl=AgCl↓+HNO3(生成沉淀的酸盐反应)
反应4:碱+盐→新碱+新盐
说明:
a.碱盐反应均可溶,生成物中有沉淀
b.生成物中的沉淀可以是:难溶性碱;难溶性盐;难溶性碱+难溶性盐
经典反应:
a.Ca(OH)2+Na2CO3= CaCO3↓+2NaOH(工业用纯碱制烧碱的原理)
b.2NaOH+CuSO4= Cu(OH)2↓+Na2SO4(教材中生成蓝色沉淀演示实验)
c.Ba(OH)2+MgSO4=BaSO4↓+Mg(OH)2↓(生成双沉淀的碱盐反应)
d.Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓(生成双沉淀的碱盐反应)
e.3Ba(OH)2+Fe2(SO4)3=3BaSO4↓+2Fe(OH)3↓(生成双沉淀碱盐反应)
反应5:盐+盐→新盐+新盐
说明:
a.两盐反应均可溶,生成物中有沉淀
b.能作反应物的碳酸盐只有:K2CO3、Na2CO3、(NH4)2CO3(可溶),其他的碳酸盐均为难溶、微溶、不存在或遇水分解,故不能做此类反应的反应物
经典反应:
a.NaCl + AgNO3= AgCl↓+NaNO3(NaCl初中阶段唯一参加的反应)
 爱华网
爱华网



