一、考纲要求
1.了解组成物质的分子、原子、离子、元素等概念的含义;初步了解原子团的定义。
2.理解物理变化与化学变化的区别与联系。
3.理解混合物和纯净物、单质和化合物、金属和非金属的概念。
4.了解同素异形体的概念,了解物质分类方法及其重要作用。
5.理解酸、碱、盐、氧化物的概念及其相互联系。
6.知道胶体是一种常见的分散系,了解丁达尔效应。
本考点高考主要题型为选择题,多为概念辨析类正误判断,考查层次为了解、理解。
二、知识梳理
1.物质的组成
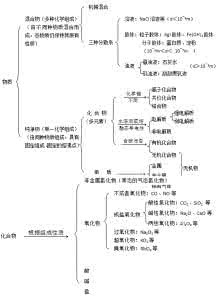
注意 (1)游离态和化合态是元素在自然界中的两种存在形态,以单质形式存在的称为元素的游离态,以化合物形式存在的称为元素的化合态,
(2)质子、中子、电子是构成原子的3种基本粒子,原子、分子、离子是组成物质的3种基本粒子。
2.物质的分类
按照不同的分类依据,对物质有不同的分类方法,常见的有交叉分类法和树状分类法。对化学物质运用树状分类法可呈现以下图示:
(1)混合物
(2)纯净物
①单质
②
注意:氧化物指由两种元素组成,其中一种元素为氧元素的化合物,
酸性氧化物不一定为非金属氧化物,如Mn2O7;
非金属氧化物不一定为酸性氧化物,如CO;碱性氧化物一定为金属氧化物;
金属氧化物不一定为碱性氧化物,如Al2O3为两性氧化物,Mn2O7为酸性氧化物;
酸性氧化物一定为酸酐;酸酐不一定为酸性氧化物,如乙酸酐[(CH3CO)2O]不属于氧化物。
3.分散系的分类
(1)按照分散质和分散剂聚集状态(气、固、液)的差别对分散系进行分类,有九种类型。
(2)按照分散质粒子大小的差别对分散系进行分类,有三种类型:
4.胶体
(1)胶体区别于其他分散系的本质:分散质颗粒直径在1nm~100nm之间。这是胶体的本质特征,也是胶体具有其他分散系所没有的性质的原因。
(2)胶体的物理性质:①丁达尔效应;②介稳性;③胶粒不能透过半透膜,能透过滤纸。
[注意]丁达尔效应是区别胶体与溶液的常用的重要的方法;渗析是提纯、精制胶体的常用的、重要的方法。
(3)胶体的制备
①制备胶体的实质:制备胶体的实质就是制备分散质粒子直径在1nm~100nm范围之内的分散系。很多物质都能够制成胶体。
②制备胶体的方法:a.通过化学反应制备胶体,例如将少量饱和的三氯化铁溶液滴加到沸腾的蒸馏水中,继续加热至液体呈红褐色,就制得了浓度较大的氢氧化铁胶体。
将明矾等铝盐溶于水就制得了浓度较小的氢氧化铝胶体。
b.通过物理变化制备胶体,例如将淀粉溶于热水就制得了淀粉胶体;硫黄的酒精溶液加到水中就制得了硫黄胶体。
5.三类分散系的比较
分散系
溶液
胶体
浊液
分散制裁粒子的直径
<1nm
1nm~100nm
>100nm
分散系的外观特征
均一、澄清、透明
较均一、澄清、透明
不均一、浑浊、不透明
分散质粒子类型
小分子或阴、阳离子
分子的集合体或高分子
大量分子的集合体
分散质粒子能否透过滤纸
能透过
能透过
不能透过
分散质粒子能否透过半透膜
能透过
不能透过
不能透过
分散系的稳定性
很稳定
较稳定
不稳定,分散质与分散剂易分离
6.净水剂及其作用原理
胶体粒子的直径一般在1nm~100nm之间,它决定了胶体粒子具有巨大的表面积,吸附力很强,能在水中吸附悬浮固体或色素形成沉淀,从而使水净化,这就是胶体净水的原理。
7.鉴别不同类分散系的方法
(1)浊液的物理特征是不稳定,分散剂与分散质易分离,而溶液很稳定,胶体比较稳定。因此,当浊液与溶液、胶体的外观特征相同或相似时,可以通过静置观察的方法进行鉴别。如果经过静置仍无变化的液体是溶液或胶体;如果经过静置出现浑浊或沉淀现象的液体是悬浊液;如果经过静置出现分层现象的液体是乳浊液。
(2)胶体的物理特征是具有丁达尔现象。因此,当溶液与胶体的外观特征相似或相同时,可以通过在暗室里用聚光照射,观察有无光柱来鉴别。如果液体里产生光柱,该液体是胶体溶液;如果液体里不产生光柱,该液体是溶液。
8.物质变化过程中的“三馏”“四色”“五解”和“十八化”
[注意]①化学变化中组成物质的元素的化合价不一定发生变化,如O3与O2间的相互转化。
②化学变化中一定存在化学键的断裂和形成,但存在化学键断裂的变化不一定是化学变化,如金属熔化、NaCl溶于水均属于物理变化。
 爱华网
爱华网