一、什么是医疗器械登记事项变更和许可事项变更
依据《医疗器械注册管理办法》(食品药品监管总局令第4号)第六章第四十九条和《境内第三类和进口医疗器械注册审批操作规范》(食药监械管[2014]208号),《医疗器械注册证》及其附件所列内容为注册限定内容,已注册的第二类、第三类医疗器械,医疗器械注册证及其附件载明的内容发生变化,注册人应当向原注册部门申请注册变更。
注册变更分为登记事项变更和许可事项变更。
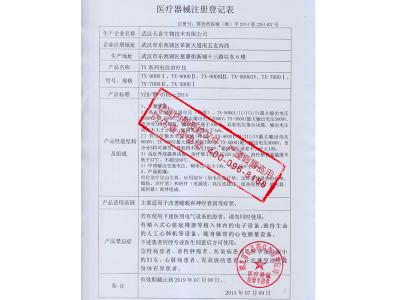
注册证中注册人名称和住所、代理人名称和住所发生变化的,注册人应当向原注册部门申请登记事项变更;境内医疗器械生产地址发生变化的,注册人应当在相应的生产许可变更后办理注册登记事项变更。
而注册证及其附件载明的产品名称、型号、规格、机构及组成、适用范围、产品技术要求、进口医疗器械生产地址和“其他内容”栏目中相应内容等发生变化的,注册人应当向原注册部门申请许可事项变更。
对于未在注册证及其附件载明的内容发生变化的,企业应按照其自身质量管理体系要求做好相关工作,并保证其质量管理体系的持续有效运行。
二、医疗器械登记事项变更和许可事项是否可以同时申请
根据总局受理和举报中心《关于医疗器械(含体外诊断试剂)注册申报有关问题的公告》(第129号),登记事项变更和许可事项变更可以分别申请,也可以合并申请。
合并申请的,申请人应当分别填写《医疗器械/体外诊断试剂注册登记事项变更申请表》和《医疗器械/体外诊断试剂注册许可事项变更申请表》,并在“其他需要说明的问题”中标明合并登记事项/许可事项变更。同一产品的不同注册申请中如使用相同的资料(包括证明性文件和技术性资料),可仅提供一份资料原件随同任何一个注册申请申报,其他申请中需注明该项申报资料原件出处。
在2015年4月1日后,上述事项依然可以同时申请,同时申请同《关于医疗器械(含体外诊断试剂)注册申报有关问题的公告》(第129号)要求。相关申请按照许可事项变更申请的程序办理。
三、什么是获准注册的医疗器械
获准注册的医疗器械,是指与该医疗器械注册证及附件限定内容一致且在医疗器械注册证有效期内生产的医疗器械。
四、相关公证要求是指什么
依据《境内第三类和进口医疗器械注册审批操作规范》(食药监械管[2014]208号)明确,进口产品申报资料,如无特别说明,原文资料均应由申请人签章。原文资料“签章”是指:申请人法定代表人或者负责人签名,或者签名并加盖组织机构印章,并且应当提交由申请人所在地公证机构出具的公证件。
其公证主要是针对原文资料相应“签章”,以便于确保进口产品注册申请及其提供的资料,确系申请人自身的真实意愿,其相关行为真实。
延伸阅读:第六届中国(天津)国际医疗器械展览会从服务到流量 医药电商难成移动医疗推手公立医疗卫生机构绩效咋评价CFDA发布国家医疗器械质量公告护士开错清单多460元医疗费 患者称态度恶劣开信息化良方应对“过度医疗” 爱华网
爱华网



