相关解答一:金属铱的性质
元素名称:铱
元素原子量:192.2
元素类型:金属
体积弹性模量:GPa 320
原子化焓:kJ /mol @25℃ 628
热容:J /(mol· K) 25.10
导热系数:W/(m·K) 147
导电性:10^6/(cm ·Ω )0.197
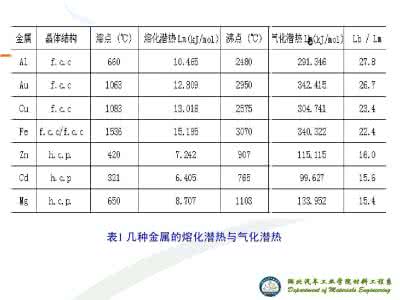
熔化热:(千焦/摩尔) 26.10
汽化热:(千焦/摩尔) 604.0
原子体积:(立方厘米/摩尔) 8.54
密度:(g/cm^3 )22.42
元素在宇宙中的含量:(ppm)0.002
元素在太阳中的含量:(ppm) 0.002
地壳中含量:(ppm) 0.000003
氧化态:Main Ir+3, Ir+4 Other Ir-1, Ir0, Ir+1, Ir+2, Ir+5, Ir+6
晶体结构:晶胞为面心立方晶胞,每个晶胞含有4个金属原子。
晶胞参数:a = 383.9 pm b = 383.9 pm c = 383.9 pm α = 90° β = 90° γ = 90°
莫氏硬度:6.5
声音在其中的传播速率:(m/S) 4825
发现人:台奈特(Tennant) 发现年代:1803年
发现过程: 1803年,由英国人台奈特(Tennant)发现。
元素描述: 第一电离能9.1电子伏特。银白色金属,硬而脆。热加工时,只要不退火,可延展加工成细丝和薄片;一旦退火,就失去延展性变得硬脆。密度22.42克/厘米3。熔点2410±40℃,沸点4130℃。面心立方晶体。化学性质很稳定。不溶于酸。稍溶于王水;稍受熔融得氢氧化钠、氢氧化钾和重铬酸钠得侵蚀。有形成配位化合物得强烈倾向。主要化合价+2、+4、+6。
元素来源: 在地壳中含量仅有9×10-9%。主要存在于锇铱矿中。可用锌与在提炼铂时所得得锇铱合金中分离制得。
元素用途: 纯铱专门用在飞机火花塞中,多用于制作科学仪器、热电偶、电阻线等。做合金用,可以增强其他金属得硬度。它与铂形成得合金(10%的Ir和90%的Pt),因膨胀系数极小,常用来制造国际标准米尺,世界上的千克原器也是由铂铱合金制作的。
元素辅助资料: 铱属铂系元素。铂系元素几乎完全成单质状态存在,高度分散在各种矿石中,例如原铂矿、硫化镍铜矿、磁铁矿等。铂系元素几乎无例外地共同存在,形成天然合金。在含铂系元素矿石中,通常以铂为主要成分,而其余铂系元素则因含量较小,必须经过化学分析才能被发现。由于锇、铱、钯、铑和钌都与铂共同组成矿石,因此它们都是从铂矿提取铂后的残渣中发现的。
铂系元素化学性质稳定。它们中除铂和钯外,不但不溶于普通的酸,而且不溶于王水。铂很易溶于王水,钯还溶于热硝酸中。所有铂系元素都有强烈形成配位化合物的倾向。
1803年,法国化学家科勒德士戈蒂等人研究了铂系矿石溶于王水后的渣子。他们宣布残渣中有两种不同于铂的新金属存在,它们不溶于王水。1804年,泰纳尔发现并命名了它们。其中一个命名为irdium(铱),元素符号定为Ir。这一词来自希腊文iris,原意是“虹”。这可能是由于二氧化铱的水合物IrO2·2H2O或Ir(OH)4,从溶液中析出沉淀时,颜色或青、或紫、或深蓝、或黑,随着沉淀的情况而改变。
[编辑本段]【化学符号Ir】
属于周期表Ⅶ族过渡元素,原子序数77,原子量192.2,面心立方晶格,是一种稀有的贵金属材料。
简史1803年英国坦南特(s.T......余下全文>>
相关解答二:金属镁的性质
镁是一个年轻的金属,20世纪才发展起来。它呈银白色,熔点649℃,质轻,密度为1.74克/厘米3,约为铜的1/4、铝的2/3;其化学活性强,与氧的亲合力大,常用做还原剂,去置换钛、锆、铀、铍等金属。粉状或细条状的镁,在空气中很易燃烧,燃烧时发出眩目的白光。镁与氟化物、氢氟酸和铬酸不发生作用,也不受苛性碱侵蚀,但极易溶解于有机和无机酸中。镁能直接与氮、硫和卤素等化合。金属镁无磁性,且有良好的热消散性。
镁是地壳中含量高、分布广的元素之一。具有工业价值的矿物有;花菱镁矿、白云石、光卤石。另外,海水也将成为镁资源产地。工业上利用电解熔融氧化镁或在电炉中用硅铁等使其还原而制得金属镁,前者叫做熔盐电解法,后者叫做硅热还原法。
物理性质:质软,熔点较低,成银白色。镁是一种柔软有光泽的金属
化学性质:1.与非金属单质的反应: 2Mg+O2==2MgO 3Mg+N2=Mg3N2 2。与水的反应: Mg+2H2O=Mg(OH)2+H2(加热) 3。与酸的反应:Mg+2HCl+MgCl2+H2 4.与氧化物的反应:2Mg+CO2=2MgO+C(点燃)
元素名称:镁
元素原子量:24.31
元素类型:金属
发现人:戴维 发现年代:1808年
发现过程:
1808年,英国的戴维,用钾还原白镁氧,最早制得少量的镁。
元素描述:
银白色的金属,密度1.74克/厘米3,熔点648.8℃。沸点1107℃。化合价+2,电离能7.646电子伏特,是轻金属之一,具有展性,能与热水反应放出氢气,燃烧时能产生眩目的白光,许多金属是用热还原其盐和氧化物来制备。金属镁能与大多数非金属和差不多所有的酸化合,大多数碱,以及包括烃、醛、醇、酚、胺、脂和大多数油类在内的有机化学药品与镁仅仅轻微地或者根本不起作用。
元素来源:
镁存在于菱镁矿MgCO3、白云石CaMg(CO3)2、光卤石KCl·MgCl2·H2O中,海水中也含镁盐。可以由电解熔融的氯化镁或光卤石制得。
元素用途:
主要用于制造轻金属合金、球墨铸铁、汽车、飞机、科学仪器脱硫剂脱氢和格氏试剂,也能用于制烟火、闪光粉、镁盐等。
元素辅助资料:
镁是在自然界中分布最广的十个元素之一,但由于它不易从化合物中还原成单质状态,所以迟迟未被发现。
长时期里,化学家们将从含碳酸镁的菱镁矿焙烧获得的镁的氧化物苦土当作是不可再分割的物质。在1789年拉瓦锡发表的元素表中就列有它。1808年,戴维在成功制得钙以后,使用同样的办法又成功的制得了金属镁。
从此镁被确定为元素,并被命名为magnesium,元素符号是Mg。Magnesium来自希腊城市美格里西亚Magnesia,因为在这个城市附近出产氧化镁,被称为magnesia alba,即白色氧化镁。不过镁的名称magnesium很容易和锰的名字manganum混淆,虽然有人提出更改,却一直沿用下来。
元素符号: Mg 英文名: Magnesium 中文名: 镁
相对原子质量: 24.305 常见化合价: +2 电负性: 1.31
外围电子排布: 3s2 核外电子排布: 2,8,2
同位素及放射线: *Mg-24 Mg-25 Mg-26 Mg-27[9.45m] Mg-28[21h]
电子亲合和能: -21 KJ·mol-1
第一电离能: 738 KJ·mol-1 第二电离能: 1451 KJ·mol-1 第三电离能: 7733 KJ·mol-1
单质密度: 1.738 g/cm3 单质熔点: 650......余下全文>>
相关解答三:金属铝的所有性质
铝的物理性质
铝是银白色的轻金属,较软,密度2.7g/cm3,熔点660.4℃,沸点2467℃,铝和铝的合金具有许多优良的物理性质,得到了非常广泛的应用。
铝对光的反射性能良好,反射紫外线比银还强,铝越纯,它的反射能力越好,常用真空镀铝膜的方法来制得高质量的反射镜。真空镀铝膜和多晶硅薄膜结合,就成为便宜轻巧的太阳能电池材料。铝粉能保持银白色的光泽,常用来制作涂料,俗称银粉。
纯铝的导电性很好,仅次于银、铜,在电力工业上它可以代替部分铜作导线和电缆。铝是热的良导体,在工业上可用铝制造各种热交换器、散热材料和民用炊具等。
铝有良好的延展性,能够抽成细丝,轧制成各种铝制品,还可制成薄于0.01mm的铝箔,广泛地用于包装香烟、糖果等。
相关解答四:金属与非金属物理性质的比较
非金属 金属
密度小 密度大
没有金属光泽无特定颜色有 金属光泽,有颜色
基本无导电性 一般都能导电
导热性各异 导热性各异
大都没有延展性 一般有延展性
楼下的 非主流,不太道德哦- -复制我们3人答案0 0
相关解答五:初中所有金属的性质! 20分
一、金属材料
1、金属材料
纯金属(90多种)
合金 (几千种)
2、金属的物理性质: (1)常温下一般为固态(汞为液态),有金属光泽。
(2)大多数呈银白色(铜为紫红色,金为黄色)
(3)有良好的导热性、导电性、延展性
3、金属之最:
(1)铝:地壳中含量最多的金属元素(2)钙:人体中含量最多的金属元素
(3)铁:目前世界年产量最多的金属(铁>铝>铜)
(4)银:导电、导热性最好的金属(银>铜>金>铝)
(5)铬:硬度最高的金属 (6)钨:熔点最高的金属
(7)汞:熔点最低的金属 (8)锇:密度最大的金属
(9)锂 :密度最小的金属
4、金属分类:
黑色金属:通常指铁、锰、铬及它们的合金。
重金属:如铜、锌、铅等
有色金属
轻金属:如钠、镁、铝等;
有色金属:通常是指除黑色金属以外的其他金属。
5、合金:由一种金属跟其他一种或几种金属(或金属与非金属)一起熔合而成的具有金属特性的物质。
★:一般说来,合金的熔点比各成分低,硬度比各成分大,抗腐蚀性能更好
合金
铁的合金
铜合金
焊锡
钛和钛合金
形状记忆金属
生铁
钢
黄铜
青铜:
成分
含碳量
2%~4.3%
含碳量
0.03%~2%
铜锌
合金
铜锡
合金
铅锡
合金
钛镍合金
备注
不锈钢:含铬、镍的钢
具有抗腐蚀性能
紫铜为纯铜
熔点低
注:钛和钛合金:被认为是21世纪的重要金属材料,钛合金与人体有很好的“相容性”,
因此可用来制造人造骨等。
(1)熔点高、密度小
优点 (2)可塑性好、易于加工、机械性能好
(3)抗腐蚀性能好
二、金属的化学性质
1、大多数金属可与氧气的反应
2、金属 + 酸 → 盐 + H2↑
3、金属 + 盐 → 另一金属 + 另一盐(条件:“前换后,盐可溶”)
Fe + CuSO4 == Cu + FeSO4 (“湿法冶金”原理)
三、常见金属活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
在金属活动性顺序里:
(1)金属的位置越靠前,它的活动性就越强
(2)位于氢前面的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸)
(3)位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来。(除K、Ca、Na)
四、金属资源的保护和利用
1、铁的冶炼
(1)原理:在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。
3CO + Fe2O3高温2Fe + 3CO2
(2)原料:铁矿石、焦炭、石灰石、空气
常见的铁矿石有磁铁矿(主要成分是Fe3O4 )、赤铁矿(主要成分是Fe2O3 )
2、铁的锈蚀
(1)铁生锈的条件是:铁与O2、水接触(铁锈的主要成分:Fe2O3·XH2O)
(铜生铜绿的条件:铜与O2、水、CO2接触。铜绿的化学式:Cu2(OH)2CO3)
(2)防止铁制品生锈的措施:
①保持铁制品表面的清洁、干燥
②表面涂保护膜:如涂油、刷漆、电镀、烤蓝等
③制成不锈钢
(3)铁锈很疏松,不能阻碍里层的铁继续与氧气、水蒸气反应,因此铁制品可以全部被锈蚀。因而铁锈应及时除去。
(4)而铝与氧气反应生成致密的氧化铝薄膜,从而阻止铝进一步氧化,因此,铝具有很好的抗腐蚀性能。
3、金属资源的保......余下全文>>
相关解答六:金属钼的性质 用途 5分
1、银白色金属,硬而坚韧,是难熔金属元素之一,在元素周期表中为VI B 族元素,原子序数42,原子量95.94,密度10.2克/厘米3,熔点2610℃,沸点5560℃。化合价+2、+4和+6,稳定价为+6。第一电离能7.099电子伏特。在常温下不受空气的侵蚀。跟盐酸或氢氟酸不起反应。
2、在常温下钼在空气或水中都是稳定的,但当温度达到400℃时开始发生轻微的氧化,当达到600℃后则发生剧烈的氧化而生成MoO 3 。在很储的温度下钼于氢也不相互反应,但在1500℃与氮发生反应形成钼的氮化物。在1100 ~ 1200℃以上与碳、一氧化碳和碳氢化合物反应生成碳化物如MoSi 2 ,此MoSi 2 即使在1500 ~ 1700℃的氧化气氛中仍是相当稳定的,不会被氧化分解。
钼原子有两个不完全的电子层,它在各种钼化合物中可为2、3、4、5或6价,这就是说钼可形成许多种类的化合物。然而钼最主要的化合物为氧化物、钼酸及各种类型的钼酸盐。钼的主要化学性质如表所示。
介质 试验条件 反应情况
水 不腐蚀
HF 冷、热 不腐蚀
HF+H2SO4 冷 不腐蚀
HF+H2SO4 热 轻微腐蚀
HF+王水 冷 轻微腐蚀
HF+王水 热 迅速腐蚀
HF+HNO3 冷、热 迅速腐蚀
氨水 不腐蚀
熔融碱 大气中 轻微腐蚀
熔融碱 氧化剂如KNO3 , KNO2 、KclO3 、PbO2中 迅速腐蚀
硼 在高温下 生成硼化物
碳 1100℃以上 生成碳化物
硅 1100℃以上 生成硅化物
磷 至最高温度 不腐蚀
硫 440℃以上 生成硫化物
碘 790℃以下 不腐蚀
溴 840℃以下 不腐蚀
氯 230℃以上 强烈腐蚀
氟 室温 强烈腐蚀
空气和氧 400℃ 开始氧化
空气和氧 600℃ 强烈氧化
空气和氧 700℃以上 MoO3 升华
氢和惰性气 至最高温度 不反应
CO 1400℃以上 生成碳化物
CO 2 1200℃ 氧化
碳氢化合物 1100℃ 生成碳化物
Al Ni Fe Co Sb 熔融体 强烈腐蚀
Zn 熔融体 轻微腐蚀
Bi 熔融体 高度腐蚀
玻璃 熔融体 高度腐蚀
难熔氧化物Al2O3 ,ZrO2 ,BeO,MgO,ThO2 1700℃以下 不腐蚀
氮气 1100℃以上 氮化反应
第二个问题:盐酸、氢氟酸、稀硝酸及碱溶液对钼均不起作用。钼可溶于硝酸、王水或热硫酸溶液中。
第三个问题:
AG:银的化学性质最活泼,它能溶于硝酸生成硝酸银;易溶于热的浓硫酸,微溶于热的稀硫酸;在盐酸和“王水”中表面生成氯化银薄膜;与硫化物接触时,会生成黑色硫化银
cu:铜不能跟稀盐酸、稀硫酸发生反应,但能溶于稀硝酸。铜不跟冷的浓硫酸反应,但能跟热的浓硫酸、浓盐酸和浓硝酸反应
MO:盐酸、氢氟酸、稀硝酸及碱溶液对钼均不起作用。钼可溶于硝酸、王水或热硫酸溶液中。
CR: 铬能溶于稀HCl,H2SO4 。铬在硝酸、磷酸或HClO4中是惰性的,这是由于生成氧化物保护层而钝化
综合判断 应该是热的硫酸吧...余下全文>>
相关解答七:金属的化学性质有哪些
主要是还原性,还有与水反应,与氧气反应,与酸反应,置换反应等等。
相关解答八:金属的化学性质是什么?
大部分金属和氧气,和非金属,和活动性表其后的金属盐溶液,氢前金属和酸反应,此为金属化学性质
相关解答九:金属有哪些化学性质
金属的主要化学反应表现在原子形成阳离子:
【】与水反应,例如钠与水反应,置换出氢气;
【】与酸反应,例如锌与硫酸反应,置换出氢气;
【】与氧反应,例如镁与氧气反应生成氧化镁。
相关解答十:金属钠的性质是什么?
物理性质:
银白色立方体结构金属。
质软而轻。
相对密度(H2O)0.968。熔点97.82℃。沸点881.4℃。有腐蚀性。
化学:
在空气中氧化转变为暗灰色。
遇水剧烈反应,生成氢氧化钠和氢气并产生大量热量而自燃或爆炸。
在空气中,燃烧时发亮黄色火焰。
遇乙醇也会反应,跟乙醇的羟基反应,生成氢气和乙醇钠,同时放出热量。
能与卤素和磷直接化合。
能还原许多氧化物成元素状态,也能还原金属氯化物。参考资料:baike.baidu.com/view/4631.htm
百度搜索“爱华网”,专业资料,生活学习,尽在爱华网
 爱华网
爱华网