化学计量,是高中化学的基础。
物质的量,是化学计量的基础。
一、物质的量
我们已经用了一次课,讲了“物质的量(符号为n,单位是mol、摩尔或摩)”的概念。这是一个新的计量单位,在后面的学习中要尽快熟悉这个概念,就象物理中的长度(单位是米、厘米等)、质量(单位是千克、克等)那样去熟悉物质的量(单位是摩、摩尔)。需要深刻理解:
1)物质的量的含义:是用来描述肉眼看不见的粒子的数目的概念,就是含有多少多少个这样的小微粒。这些小微粒可以是原子、分子、离子、电子、质子、中子、原子团。
2)物质的量的符号和单位:物质的量用 n 表示,单位用 mol 表示,中文用“摩尔”或“摩”。因此,物质的量也称之为摩尔数。
3)摩尔的微观含义:因为这些小微粒数量太大了,很难数得清,几千、几万个根本就够数,于是用一个阿伏加德罗常数 NA 来表示。
NA 这么多个粒子,就定义为 1 mol(1摩尔)。物质含有的粒子数就叫做摩尔数。微观上,摩尔数的计算公式为
(1)
N —— 物质所含粒子的个数。
二、摩尔质量
关于物质的量,我们有了微观上的定义,但是还需要转化到宏观的应用上。
2.1 物质的量,是微观的定义
通常化学上计量物质,都是采用克、千克这样宏观的量,而不是去数一数物质含有粒子的个数(也数不清),因此物质的量使用起来就不那么方便。
2.2 物质的量,宏观上的应用
需要掌握物质的量的应用方法,就是宏观上的应用。:实际上,物质含有的粒子数是很大很大的一个数量级,公式(1)的应用很不方便,而是使用比较大的、宏观上的量。
N 个粒子的质量 —— 用 m 表示,单位为克,g
NA 个粒子的质量 —— 恰好是 1 mol 粒子的质量,数值等于相对分(原)子质量,单位为克,g。
2.3 摩尔质量
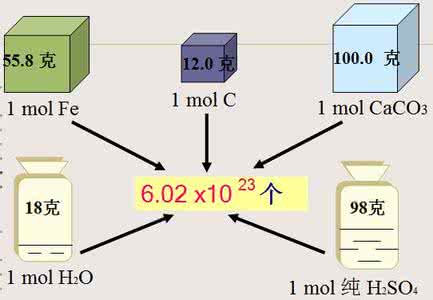
对于分子,NA 个分子的质量,数值上等于相对分子质量(M);对于原子,NA个原子的质量,数值上等于相对原子质量(A)。例如,1 mol氧分子的质量为 32 g;1 mol碳原子的质量为 12 g,等等。
1 mol物质的质量,就称之为摩尔质量(M)。摩尔质量的单位为克(g/mol),在数值上等于它的相对分子质量或相对原子质量。
图1、一些物质的摩尔质量(示意图)
物质的量(摩尔数)在宏观上的计算公式为
(2)
2.4 物质的量,例题
例题1:含有3倍的 NA 那么多的氧分子,物质的量是多少摩尔?这些氧分子的质量是多少克?
(分析:氧分子的相对分子质量是 32 碳单位,氧气的摩尔质量就是 32 g)
答:其物质的量是 3 mol,质量为 32 * 3 = 96 g。
例题2:含有1.5倍那么多的碳原子,物质的量是多少?这些碳原子的质量是多少克?
(分析:碳原子的相对原子质量是 12 碳单位,碳的摩尔质量就是 12 g/mol)
答:其物质的量是 1.5 mol,质量为 12 * 1.5 = 18 g。
三、气体摩尔体积
这一节讨论物质的体积。
化学中所涉及的物质,有固态、液态、气态三种。微观上,物质由原子或分子构成。
3.1 固体和液体的粒子间距很小
固体物质和液体物质中,粒子间的距离很小,粒子大小和多少决定了物质的体积。
图2、粒子多少决定固体和液体的体积
图3、粒子大小决定固体和液体的体积
固态的物质可以用天平称量它的质量,很方便;液体物质,可以用天平称量它们的质量,也可以用量筒称量它们的体积。
3.2 气体粒子之间的间距很大
气态物质(气体)的粒子之间距离很大,体积很大,很难称量它们的质量,但是称量气体的体积却比较方便。
图4、气体物质的粒子间距离很大
气体,经常称量它们的体积。
生活上常常说到“热胀冷缩”,气体在这方面尤其明显。受热的时候,气体膨胀,压强减小;在冷却的时候,气体收缩,压强减小。这里,我们无意中涉及到了影响气体体积的两个因素:
冷、热——温度
胀、缩——压强
说到气体的体积,一定要说明处于何种温度、何种压强的条件下。
3.3 气体粒子(分子或离子)本身的体积可以忽略不计
物质从固态(或液态)变为气态的时候,体积膨胀了许多许多。以水为例,1 mol水蒸发为水蒸气,体积扩大了1700倍左右。
图5、气体体积扩大,气体粒子间距很大
气体粒子之间的间距很大很大。相比较而言,气体粒子本身的体积就可以忽略不计。
在一定温度、一定压强下,气体物质的体积就完全由所含气体的粒子数(或者说,物质的量)决定了,而与气体种类无关。
换句话说,比如在 0℃、101 KPa条件下,1 mol任何气体的体积都相同。这个条件就叫做“标准状况”,有的化学老师称之为“标况”。
1 mol 气体的体积,就叫做摩尔体积。
实验测得,在标准状况下,氧气的密度是 1.429 g/L,氢气的密度是 0.0899 g/L。
例题3:计算标准状况下氧气摩尔体积是多少升?
解:
(1)根据初中物理学到的体积、密度计算公式
(3)
得到气体的体积
(4)
(2)已知氧气的密度 r = 1.429 g/L,1 mol氧气的摩尔质量为 32 g
(3)1 mol氧气的体积 V 为
V = 32 g ÷ 1.429 g/L ≈ 22.4 L/mol
答:在标准状况下,1 mol氧气的体积大约为 22.4 L。
例题4:计算标准状况下氢气的摩尔体积是多少升?
解:
(1)根据
(4)
(2)已知氢气的密度 r = 0.0899 g/L,1 mol氢气的摩尔质量为 2 g/mol
(3)1 mol氢气的体积 V 为
V = 2 g ÷ 0.0899 g/L ≈ 22.4 L/mol
答:在标准状况下,1 mol氢气的体积大约为 22.4 L。
经过大量实验证明,任何气体在标准状况下的体积,都为22.4 L。
具体见下面的示意图。
这个示意图形象地说明了标准状况下气体的摩尔体积(单位 L/mol)。如果条件变化了,比如温度、压强有了变化,1 mol气体的体积就可能不是 22.4 L了。
例题5:在 0℃、101 KPa条件下,1 mol 任何气体的体积是 22.4 L。而在25℃、101 KPa条件下,1 mol任何气体的体积大约为 24.5 L。
虽然后面的压强没有变化,但是温度升高了,气体的体积增大了,从 22.4 L 增加到了 24.5 L。
这两节课,物质的量n与摩尔质量M,非常重要(上节课说了),可以说是高中化学基础中的基础,关键中的关键,重点中的重点。因此费了半天口舌,说了很多道理,举了很多例子,插了不少插图,希望同学们能够从其中的方法中找到自己的契合点,尽快掌握这两个概念。
下节课的内容,《物质的量的应用,物质的量浓度》,会延伸本节课的内容。
“物质的量浓度”是溶液的基础。我们在初三学过的溶液,只是小打小闹,甚至小打小闹都算不上,高中的溶液可要见真章了。
高中化学的溶液,主要在《离子反应》、《电解质溶液》这两章,每年高考,出题老师从来都不放过“溶液”这个考点,考分40-50分/100分,实在是太重要了。
而要学好溶液,要先学好物质的量浓度。
要学好物质的量浓度,要先学好摩尔质量,也就是这节课。
要学好摩尔质量,要先学好物质的量,就是上节课。
一环套一环,环环相扣。循环往复,波浪式前进,我们的知识层次和能力就逐渐提高了。
 爱华网
爱华网


