哈佛医学院Dana-Farber癌症研究所及其他机构的研究人员日前利用全外显子组测序,发现了两个过去未知的突变。这两个突变似乎引起癌症患者对药物的意外响应以及之后的耐药。
患者是一名57岁的女性,患有转移性甲状腺未分化癌(ATC)。这是一种恶性程度很高的甲状腺癌,通常在5个月内致命。不过,在接受依维莫司(everolimus)治疗后,这位患者在18个月内几乎完全缓解,但随后还是继续发展。
这项研究于10月9日发表在《新英格兰医学杂志》上,强调了肿瘤的重复测序可能有助于指导患者的治疗,并了解药物敏感性和耐药性。
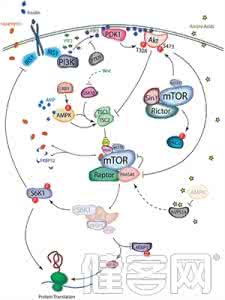
通过测序治疗前的肿瘤和耐药的肿瘤,研究人员在治疗前肿瘤的TSC2中发现了一个无义突变,TSC2是mTOR的负调控因子。这个突变可以解释患者对依维莫司(mTOR抑制剂)的响应。同时,他们又在耐药肿瘤中发现了一个mTOR突变,这导致患者对mTOR抑制剂的耐受。
研究小组对患者的治疗前肿瘤、耐药肿瘤和血液进行了全外显子组测序,平均覆盖度大约在300x至375x,以便弄清插入缺失和拷贝数改变。
研究人员报道,治疗前肿瘤在TSC2中含有一个无义突变。这个截断的突变使蛋白质失活,反过来激活mTOR通路。他们称,这使得有些癌症对mTOR抑制敏感,不过这种突变之前在甲状腺癌中未报道过。
他们还发现了317个SNV和44个编码的插入缺失,包括一个TP53突变和一个FLCN的移码突变,这个肿瘤抑制基因也参与了TSC2和mTOR信号。除了这些突变,耐药肿瘤还含有一个mTOR突变。
研究人员发现,对于治疗前肿瘤和耐药肿瘤,98%-100%的癌细胞都存在TP53、FLCN和TSC2突变,而mTOR突变却不存在于治疗前肿瘤细胞中,而是存在于96%的耐药肿瘤中。
他们表示,这种mTOR突变位于FRB(FKBP-雷帕霉素结合)结构域,之前并没有与耐受依维莫司相关联,也未曾在患者身上发现。不过,同源突变在裂殖酵母上报道过。带有突变的mTOR酵母同源蛋白无法与FKBP-雷帕霉素相结合。这表明人类的mTOR突变可能通过阻止结合而引起对mTOR抑制的耐受。
研究人员在细胞系中发现情况确实如此。与表达野生型mTOR的肾脏细胞相比,表达突变mTOR的细胞对雷帕霉素更加耐受。这两种细胞所表达的磷酸化S6K1水平相似,这是mTOR的一个下游靶点。然而,在雷帕霉素处理后,只有表达突变mTOR的细胞仍有磷酸化S6K1。
研究人员推测,这种mTOR突变仍可能对直接的mTOR激酶抑制剂敏感。在细胞中,他们发现的确如此。在Dana-Farber癌症研究所,一种新的mTOR激酶抑制剂正进入临床试验,而这项研究中的患者即将接受此种治疗。
延伸阅读:首都国际癌症论坛举行 肿瘤将“分级诊疗”孩子瞳孔有白点长出鸡蛋大肿瘤肿瘤免疫治疗 肿瘤治疗的未来趋势2015首届肿瘤精准医疗论坛将召开专家发布五大恶性肿瘤筛查攻略北京胃肠肿瘤精准医疗国际高峰论坛在京举办 爱华网
爱华网