相关解答一:什么是理想气体
严格遵从气态方程(PV=(m/M)RT=nRT)(n为物质的量)的气体,叫做理想气体(Ideal gas.有些书上,指符合气体三大定律的气体。)从微观角度来看是指:气体分子本身的体积和气体分子间的作用力都可以忽略不计的气体,称为是理想气体。
忽略气体分子的自身体积,将分子看成是有质量的几何点;假设分子间没有相互吸引和排斥,分子之间及分子与器壁之间发生的碰撞是完全弹性的,不造成动能损失。这种气体称为理想气体。
相关解答二:“理想气体”是怎样定义的?
定义 严格遵从气态方程(PV=(m/M)RT=nRT)的气体,叫做理想气体(Ideal gas.有些书上,指符合气体三大定律的气体。)从微观角度来看是指:分子本身的体积和分子间的作用力都可以忽略不计的气体,称为是理想气体。 扩展 理想气体应该是这样的气体:
1、分子体积与气体体积相比可以忽略不计;
2、分子之间没有相互吸引力;
3、分子之间及分子与器壁之间发生的碰撞不造成动能损失。
4、在容器中,在未碰撞时考虑为作匀速运动,气体分子碰撞时发生速度交换,无动能损失。
5、解热学题的时候,简单的认为是分子势能为零,分子动能不为零。
6、理想气体的内能是分子动能之和。
扩充2
气态方程全名为理想气体状态方程,一般指克拉珀龙方程:pV=nRT。其中p为压强,V为体积,n为物质的量,R为普适气体常量,T为绝对温度(T的单位为开尔文(字母为K),数值为摄氏温度加273.15,如0℃即为273.15K)。
当p,V,n,T的单位分别采用Pa(帕斯卡),m3(立方米),mol,K时,R的数值为8.31。该方程严格意义上来说只适用于理想气体,但近似可用于非极端情况(低温或高压)的真实气体(包括常温常压)。
另外指的是克拉珀龙方程来源的三个实验定律:玻-马定律、盖·吕萨克定律和查理定律,以及直接结论pV/T=恒量。
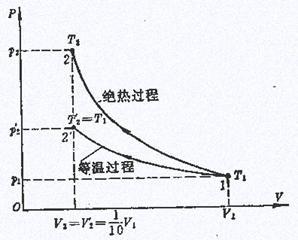
波义耳-马略特定律:在等温过程中,一定质量的气体的压强跟其体积成反比。即在温度不变时任一状态下压强与体积的乘积是一常数。即p1V1=p2V2。
盖·吕萨克定律:一定质量的气体,在压强不变的条件下,
温度每升高(或降低)1℃,它的体积的增加(或减少)量等于0℃时体积的1/273。
查理定律指出,一定质量的气体,当其体积一定时,它的压强与热力学温度成正比。即
P1/P2=T1/T2 或pt=P′0(1+t/273)
式中P′0为0℃时气体的压强,t为摄氏温度。
综合以上三个定律可得pV/T=恒量,经实验可得该恒量与气体的物质的量成正比,得到克拉珀龙方程。
相关解答三:理想气体的内能与什么有关?
质量、温度、体积、压强
相关解答四:什么是理想气体模型
严格遵从气态方程(PV=(m/M)RT=nRT)的气体,叫做理想气体(Ideal gas)。从微观角度来看是指:分子本身的体积和分子间的作用力都可以忽略不计的气体,称为是理想气体。
理想气体应该是这样的气体:
1、分子体积与气体体积相比可以忽略不计;
2、分子之间没有相互吸引力;
3、分子之间及分子与器壁之间发生的碰撞不造成动能损失。
4、在容器中,在未碰撞时考虑为作匀速运动,气体分子碰撞时发生速度交换,无动能损失。
5、解热学题的时候,简单的认为是分子势能为零,分子动能不为零。
6、理想气体的内能是分子动能之和
实际气体中,凡是本身不易被液化的气体,它们的性质很近似理想气体,其中最接近理想气体的是氢气和氦气。一般气体在压强不太大、温度不太低的条件下,它们的性质也非常接近理想气体。因此常常把实际气体当作理想气体来处理。这样对研究抚题,尤其是计算方面可以大大简化。
当气体处于高压或者低温条件下,它们的状态变化就较显著地偏离气态方程,对方程需要按实际情况加以修正。
相关解答五:理想气体指的是什么?
严格遵从气态方程(PV=(m/M)RT=nRT)的气体,叫做理想气体(Ideal gas)。从微观角度来看是指:分子本身的体积和分子间的作用力都可以忽略不计的气体,称为是理想气体。
1、理想气体又称“完全气体”(perfect gas)。是理论上假想的一种把实际气体性质加以简化的气体。人们把假想的,在任何情况下都严格遵守气体三定律的气体称为理想气体。就是说:一切实际气体并不严格遵循这些定律,只有在温度较高,压强不大时,偏离才不显著。所以一般可认为温度不低于0℃,压强不高于1.01绩10^5Pa时的气体为理想气体。
2、理想气体是一种理想化的模型,实际并不存在。实际气体中,凡是本身不易被液化的气体,它们的性质很近似理想气体,其中最接近理想气体的是氢气和氦气。一般气体在压强不太大、温度不太低的条件下,它们的性质也非常接近理想气体。因此常常把实际气体当作理想气体来处理。这样对研究问题,尤其是计算方面可以大大简化。
3、当气体处于高压、低温条件下,它们的状态变化就较显著地偏离气态方程,对方程需要按实际情况加以修正。修正的方法很多,常用的一种修正方程叫做范德瓦耳斯方程。它是以考虑分子间的相互作用以及分子本身的体积为前提,对理想气体状态方程进行修正的。
在各种温度、压强的条件下,其状态皆服从方程pV=nRT的气体。又称完美气体。它是实际气体在压强不断降低情况下的极限,或者说是当压强趋近于零时所有气体的共同特性,即零压时所有实际气体都具有理想气体性质。pV=nRT称为理想气体状态方程,或称理想气体定律。在n、T一定时,则pV=常数,即其压强与体积成反比,这就是波义耳定律(Boyle's law)。若n、p一定,则V/T=常数,即气体体积与其温度成正比,就是盖·吕萨克定律(Gay-Lussac's law)。理想气体在理论上占有重要地位,而在实际工作中可利用它的有关性质与规律作近似计算。
相关解答六:理想气体状态方程有啥用
楼上说的也对,但是我们研究实际化工热力学的时候,最开始都是通过理想气体状态方程来进行模拟再修正到实际气体
相关解答七:理想气体气体内能如何计算,急!!!
是的,后面的不清楚额。。。
相关解答八:理想气体内能是由哪些量决定的
理想气体是一种理想简化模型,当它做了忽略分子力的假设后,它的内能就不再与气体的体积有关,而只与气体的温度有关
相关解答九:什么是理想气体状态方程
理想气体状态方程,又称理想气体定律、普适气体定律,是描述理想气体在处于平衡态时,压强、体积、物质的量、温度间关系的状态方程。它建立在玻义耳-马略特定律、查理定律、盖-吕萨克定律等经验定律上。
其方程为pV = nRT。这个方程有4个变量:p是指理想气体的压强,V为理想气体的体积,n表示气体物质的量,而T则表示理想气体的热力学温度;还有一个常量:R为理想气体常数。可以看出,此方程的变量很多。因此此方程以其变量多、适用范围广而著称,对常温常压下的空气也近似地适用。
值得注意的是,把理想气体方程和克拉伯龙方程等效是不正确的。一般克拉伯龙方程是指描述相平衡的方程dp/dT=L/(TΔv)。尽管理想气体定律是由克拉伯龙发现,但是国际上不把理想气体状态方程叫克拉伯龙方程。
相关解答十:理想气体焓只是温度的函数吗?
理想气体的热力学能和焓是温度的单值函数
通常,气体的热力学能是温度和比体积的函数,但对理想气体来说,因分子之间不存在着作用力,故也就没有内位能,因此,它的热力学能仅有内动能一项,因而与其比体积无关,所以理想气体的热力学能只是温度的单值函数。
u=f(T)
据气体焓的定义
h=u+pv
对于理想气体
h=u+Rg·T
因为u=f(T),所以理想气体的焓也是温度的单值函数。也即不管其比体积如何,只要某种理想气体的温度确定后,其热力学能和焓也随之确定。
且理想气体的热力学能和焓是温度的单值函数意味着某种理想气体不论其在过程中比体积或压力如何变化,只要变化前后温度相同,其热力学能和焓的变化量也相同。
百度搜索“爱华网”,专业资料,生活学习,尽在爱华网
 爱华网
爱华网