近年来各地的高考试题中,不断地以离子间相互反应为对象,以反映中的现象为题干,设置了一些物质推断题,因此常见离子的性质显的尤为重要,因为中学阶段常见离子的鉴别和检验是我们必备的基础知识,而这些知识的形成过程是靠平时一点一滴积累起来的,为了帮助同学们更好地掌握常见离子的性质,现将其总结在一起,便于我们的复习和应用。
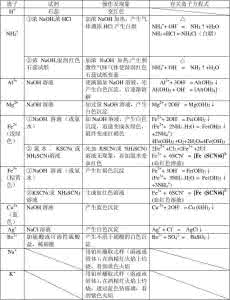
一、 常见阳离子的检验
离子
所用的试剂
主要实验现象
H+
①紫色石蕊试液
②锌片
③pH试纸
①紫色石蕊试液变为红色
②锌片表面生成无色气体
③pH试纸变为红色
Ag+
①盐酸或可溶性氯化物溶液,稀硝酸、氨水
②氢氧化钠溶液、氨水
①生成白色沉淀,该沉淀不溶于稀硝酸,但溶于氨水
②生成白色沉淀,该沉淀迅速转变成棕色,此沉淀溶于氨水,形成无色溶液
Na+
焰色反应
火焰呈黄色
K+
焰色反应
火焰呈紫色(透过蓝色钴玻璃)
Ba2+
稀硫酸或硫酸溶液、稀硝酸
生成白色沉淀,该沉淀不溶于稀硝酸
Mg2+
氢氧化钠溶液
生成白色沉淀,该沉淀不溶于过量的氢氧化钠溶液
Al3+
氢氧化钠溶液
加适量的氢氧化钠溶液有絮状白色沉淀生成,继续加氢氧化钠溶液到过量,沉淀逐渐溶解。
Fe2+
①氢氧化钠溶液
②KSCN溶液、氯水
①生成白色沉淀,在空气中迅速变成灰绿色,最后变成红褐色
②加KSCN溶液无明显现象,再加氯水后显血红色
Fe3+
①氢氧化钠溶液
②KSCN溶液
①生成红褐色沉淀
②溶液呈血红色
NH4+
氢氧化钠溶液
加热并用湿润的红色石蕊试纸检验产生的气体,试纸变蓝
二、 常见阴离子的检验
离子
所用的试剂
主要实验现象
OH-
①紫色石蕊试液
②无色酚酞试液
③pH试纸
①紫色石蕊试液变为蓝色
②无色酚酞试液变为红色
③pH试纸显蓝色至深蓝
Cl-
硝酸银溶液、稀硝酸
生成白色沉淀,此沉淀不溶于稀硝酸
Br-
硝酸银溶液、稀硝酸
生成浅黄色沉淀,此沉淀不溶于稀硝酸
I-
①硝酸银溶液、稀硝酸
②淀粉溶液、氯水
①生成黄色沉淀,此沉淀不溶于稀硝酸
②溶液显蓝色
CO32-
①氯化钡溶液、稀盐酸
②稀盐酸、澄清的石灰水
①生成白色沉淀,该沉淀溶于稀盐酸且有气泡产生
②生成的气体能使澄清的石灰水变浑浊
SO42-
稀盐酸、氯化钡
生成的白色沉淀不溶解
SO32-
①氯化钡、稀盐酸
②稀盐酸或稀硫酸、品红溶液
①生成白色沉淀,此沉淀溶于稀盐酸并放出有刺激性气味气体(SO2)
②生成的气体能使品红溶液褪色
S2-
①稀盐酸或稀硫酸
②Pb(NO3)2溶液
①生成无色有臭鸡蛋气味的气体
②生成黑色沉淀
AlO2-
稀硫酸或盐酸
有白色沉淀生成,后又溶解
【例题1】有M、N两种溶液,经测定这两种溶液中含有下列12种离子:Al3+、Cl-、Na+、K+、
NO3-、OH-、Fe2+、AlO2-、CO32-、NH4+、SO42-、H+。
(1)完成下列表格中实验①的结论和实验②的实验内容以及现象:
实验内容以及现象
结论
①取少量N溶液滴加足量的硝酸钡溶液,无沉淀产生
②
确定M溶液中含有Na+,不含K+
③用pH试纸检测M溶液,pH试纸呈蓝色
(2)根据(1)中的实验回答:
NO3-存在于________溶液中,理由是___________________;
Cl-存在于________溶液中,理由是___________________.
(3)根据(1)中的实验确定,M溶液中含有的离子为_______________.
解析:少量N溶液中滴加足量的硝酸钡溶液,无沉淀产生,说明N溶液中不含CO32-、SO42-,那么M溶液中一定含有CO32-、SO42-。取M溶液进行焰色反应,焰色为黄色,证明含有Na+,在透过蓝色钴玻璃观察火焰颜色,不呈紫色,说明M中不含K+;用pH试纸检测M溶液,pH试纸呈蓝色,说明M溶液显碱性,含有大量的OH-,那么N溶液中含有大量的H+。AlO2-不可能存在于酸性溶液中,Al3+、Fe2+、NH4+不可能存在于碱性溶液中,所以判断M溶液中有:OH-、AlO2-、CO32-、SO42-、Na+。N溶液中含有:H+、Fe2+、Al3+、NH4+、
K+。由于N溶液为酸性,又含有Fe2+,所以N溶液中不含NO3-,根据溶液呈电中性原则,可以确定Cl-存在于N溶液中。
答案:(1)N溶液中不含CO32-、SO42-或M溶液中一定含有CO32-、SO42-。
取M溶液进行焰色反应,焰色为黄色,在透过蓝色钴玻璃观察火焰颜色,不呈紫色
(2)M . N溶液中含有:H+、Fe2+、Al3+、NH4+、K+,由于N溶液为酸性,又含有Fe2+,所以N溶液中不含NO3-
N . 根据溶液呈电中性原则,可以确定Cl-存在于N溶液中。
(3) OH-、AlO2-、CO32-、SO42-、Na+、NO3-
点拨:这类试题连锁性强,解题时要十分小心,如果一种离子的存在与否判断失误,往往会导致整个题的错解。因此要仔细阅读试题中所给现象,进行一一对照,作出正确判断,同时一定要注意:澄清溶液,说明给出的离子不能产生沉淀,如果溶液中阴、阳离子只剩下一种时,不用鉴定,该阴、阳离子一定存在,因为溶液一定是电中性的。
【例题2】某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl -、Br-、I-。为了鉴别这些离子,分别取少量溶液进行以下实验:
①所得溶液呈碱性;
②加HCl后,生成无色无味的气体。该气体能使饱和石灰水变浑浊。
③加CCl4,滴加少量氯水,振荡后,CCl4层未变色。
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量的盐酸,沉淀不能完全溶解。
⑤加HNO3酸化后,再加过量的AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验,写出每一实验鉴定离子的结论与理由。
实验①____________________________。实验②____________________________。
实验③____________________________。实验④____________________________。
实验⑤________________________________________。
(2)上述5个实验不能确定是否的离子是___________________。
解析:该题主要考查离子检验、离子共存、盐类水解以及考生的语言表达能力,
(1)①NO3-、SO42-、Cl -、Br-、I-在溶液中不发生水解,CO32-、SO32-是弱酸的阴离子,在水溶液中发生水解是溶液显碱性,所以CO32-、SO32-可能存在(或至少存在其中的一种)。
②这些阴离子中,只有CO32-、SO32-能与HCl溶液反应,但SO32-与HCl溶液反应时,生成的SO2为刺激性气味的气体,而CO32-与HCl溶液反应,所得的气体无色无味,故一定存在CO32-,SO32-一定不存在。
③加入少量的氨水后,CCl4层颜色没有改变,说明原溶液中不存在Br-、I-,因为若存在二者均要与Cl2反应生成Br2、I2,导致CCl4层出现橙红色或紫红色。
④根据②已确定有CO32-,加入Ba2+后生成的沉淀部分溶于盐酸,说明原溶液中有SO42-,没有溶解的沉淀是BaSO4。
⑤容易判断沉淀是AgCl,所以溶液中肯定存在Cl -。
(2)整个实验过程中都没有设及到NO3-的鉴定,因此NO3-无法确定其有无。
答案:(1)①说明可能含有CO32-或者含有SO32-因为二者水解均显碱性;
②肯定含有CO32-,肯定不含SO32-、因SO2有刺激性气味
③肯定不含有Br-、I-,因两者均能与氯水反应后生成单质溴和单质碘,溴和碘单质溶解于CCl4显色;
④肯定含有SO42-,因BaSO4不溶于盐酸。
⑤肯定含有Cl-,因AgNO3与Cl-反应生成的AgCl不溶于稀HNO3。
(2)NO3-
点拨:②中产生的能使饱和石灰水变浑浊的气体可以使CO2和SO2,但无色无味的为CO2;加HNO3酸化,再加过量AgNO3,溶液中析出白色沉淀为AgCl,不要误认为是Ag2SO4。
【例题3】有一无色透明溶液,欲确定是否含有下列离子:
K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,实验如下:
实验步骤
实验现象
(1)取少量该溶液,加入几滴甲基橙
溶液变红
(2)取少量该溶液,加入Cu片和浓硫酸,加热
有无色气体产生,气体遇空气可以变成红棕色
(3)取少量该溶液,加入BaCl2溶液
有白色沉淀生成
(4)取(3)中反应后的上层清液,加入AgNO3溶液
有稳定的白色沉淀生成,且不溶于稀硝酸
(5)取少量该溶液,加入NaOH溶液
有白色沉淀生成,当NaOH过量时,沉淀部分溶解
由此判断:
(1)溶液中一定存在的离子是____________;溶液中肯定不存在的离子是__________;
(2)为了进一步确定其它离子,应该补充的实验及对应欲检验离子的名称(如为溶液反应,说明使用试剂的名称,不必写详细步骤)________________。
解析:(1)加甲基橙溶液变红,说明溶液显碱性,HCO3-不能存在;
(2)步说明有NO3-,在酸性条件下NO3-有强氧化性,因此还原性的离子Fe2+、I-就不能存在;
(3)步说明有SO42-,Ba2+就不能存在;
(4)步骤不能说明有Cl-,因为(3)中加入了Cl-;
(5)步说明有Mg2+和Al3+。
答案:(1)NO3-、SO42-、Mg2+、Al3+ Fe2+、HCO3-、I-、Ba2+
(2)K+的检验可以用焰色反应;Cl-的检验:向溶液中加足量的Ba(NO3)2溶液,过滤后向溶液中加AgNO3溶液,再加稀硝酸,白色沉淀不溶解。
2013-11-07 人教网 下载:
 爱华网
爱华网