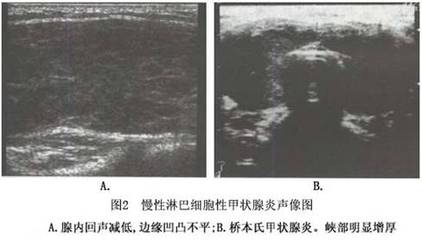
[关键词] 慢性丙型肝炎;甲状腺功能异常;甲状腺自身抗体;桥本甲状腺炎;Graves病
[中图分类号] R512.63 [文献标识码] A [文章编号] 1673-7210(2017)02(b)-0117-04
[Abstrat] Objective To investigate the character of autoimmune thyroid antibodies (TA) titer and the relationship with prognosis in patients with chronic hepatitis C (CHC) during the treatment. Methods From July 2010 to September 2016, in NO.302 Hospital of PLA, 115 CHC patients received IFN-α therapy were selected, according to clinical presentation and laboratory results, they were divided into Hashimoto's thyroiditis group (HT group), Graves group (GD group) and none AITD group, and 8 patients with HBV infected combine AITD were selected as HBV combine AITD group, 47 AITD patients without hepatitis virus infection were selected as simple AITD group. The titer of autoimmune thyroid antibodies (TG-Ab, TPO-Ab, TRAb) of all groups and different outcomes (remission group, deterioration group) of CHC patients were compared. Results Among 115 CHC patients, 24 patients (20.9%) occured AITD, 5 cases (4.3%) were GD, 16 cases (16.5%) were HD, TA of HD group, GD group and none AITD group were compared, the differences were statistically significant (P 0.05). ③ TPO-Ab, TRAb of remission group (15 cases) were significantly lower than that of deterioration group (9 cases) (P 0.05). Conclusion CHC patients received IFN-α therapy are easily progressing into AITD, TAs were different in each kind of AITD, TPO-Ab, TRAb may sensitive than TG-Ab in changing treatment plan and forecasting the thyroid prognosis. [Key words] Chronic hepatitis C; Thyroid dysfunction; Thyroid autoantibodys; Hashimoto thyroiditis; Graves
据WHO估计,全球丙型肝炎病毒(HCV)感染率约为2.8%,约1.85亿人感染HCV,每年因HCV感染而死亡的约35万人。2006年中国流行病学调查研究显示,我国60岁以下人群丙肝感染者约1000万例[1]。丙肝治疗依据不同基因型有直接抗病毒药物(DAA),其副作用小,能使大多数丙肝患者实现临床治愈,但其未在我国上市,因此聚乙二醇干扰素联合抗病毒药物仍为临床首选药物,但其临床副作用较多,能诱发甲状腺功能异常进而诱导产生甲状腺自身免疫性抗体导致自身免疫性甲状腺疾病(AITD),包括桥本甲状腺炎(HT)、弥漫性甲状腺肿(Graves病,GD)等,出现明显临床症状部分患者还需停止治疗。HCV和干扰素-α(IFN-α)等诱发AITD涉及对甲状腺细胞的直接毒性、分子模拟以及细胞因子激活等机制[2-4]。HCV相关AITD患者产生自身抗体,包括血清抗甲状腺球蛋白抗体(TG-Ab)、抗过氧化物酶抗体(TPO-Ab)、促甲状腺激素受体抗体(TRAb)。本研究组前期的研究发现TPO-Ab可以作为HCV相关AITD患者发生的独立风险因素。并且诸多研究显示不同疾病中可能存在特征性自身抗体谱,这些特征性自身抗体及其变化特点作为重要指纹图谱(fingerprint)可以作为临床诊断和治疗的重要判断指证。因此针对不同诱发因素以及不同种类的AITD患者研究特征性甲状腺自身抗体变化特点,将对该类疾病致病机制研究和临床诊治提供重要帮助。
1 资料与方法
1.1 一般资料
收集2010年7月~2016年9月在解放军第302医院(以下简称“我院”)以INF-α为基础抗病毒治疗的慢性丙型肝炎(CHC)患者115例,乙型病毒性肝炎(HBV)感染伴发AITD患者8例,未患有肝炎病毒感染的单纯AITD的患者47例。CHC患者HCV抗体阳性,HCV载量阳性,HBV伴发AITD患者乙肝表面抗原阳性,HBV病毒载量阳性,两组均无抗病毒治疗史,排除合并其他病毒感染。单纯AITD患者均为我院体检中心体检时首次发现AITD且无病毒感染的体检患者。所有纳入研究的患者均无其他严重疾病,如恶性肿瘤,严重心肺疾病、糖尿病等,排除有甲状腺疾病史患者,每次随访检查均纳入研究。随访中根据检测结果及临床表现,将CHC患者分为HT组、GD组以及未进展成AITD组,进行抗体滴度比较。比较单纯AITD患者、HBV感染伴�lAITD,HCV病毒感染的AITD患者TA滴度水平间的差异。根据随后甲功随访结果,CHC患者分为甲状腺功能缓解组、恶化组,并比较甲状腺自身抗体(TA)差异。
1.1.1 甲状腺功能异常临床定义 依据《中国甲状腺疾病诊治指南》[5]:①甲亢:促甲状腺激素 (TSH) 1.1.2 抗病毒治疗方案 参考中华医学会肝病学分会《丙型肝炎防治指南(2015年更新版)》[1]以INF-α为基础抗病毒治疗包括3种治疗方案:普通IFN-α单药治疗、普通干扰素联合利巴韦林和聚乙二醇IFN-α联合利巴韦林。根据HCV基因型,治疗期限为24~48周(基因1型感染者治疗48周,基因2、3、6型感染者治疗24周)。普通干扰素剂量为3×106~5×106 U,每周2次肌注。聚乙二醇干扰素-α剂量为180 μg或者135 μg每周1次肌注,利巴韦林为50 μg或100 μg,每周1次肌注。治疗过程中出现甲亢或甲减,应在临床医师的指导下进行相应甲状腺治疗,甲状腺功能能控制则继续抗病毒治疗,若不能控制应停止抗病毒治疗,对于发生亚临床甲亢或甲减患者可暂不处理,继续抗病毒治疗[6]。
1.2 实验室检查
TG-Ab、TPO-Ab、TRAb应用罗氏E601系列仪器及配套试剂检测,TSH、T4、FT4、T3、FT3通过强生3600化学发光免疫分析仪检测。仪器运行正常,质控在控。
1.3 统计学方法
采用统计软件SPSS 19.0对数据进行分析,正态分布计量资料以均数±标准差(x±s)表示,多组间比较采用方差分析,两两比较采用LSD-t检验。计数资料以率表示,采用χ2检验。以P 2 结果
2.1 CHC患者一般情况
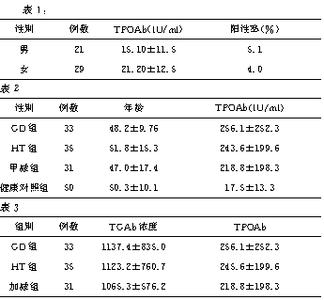
115例CHC患者随访过程中出现AITD的患者24例(20.9%),其中5例(4.3%)发生GD病,19例(16.5%)发生HT。TG-Ab、TPO-Ab、TRAb在未进展成AITD组、GD组、HT组间比较,差异有高度统计学意义(P 2.2 不同AITD患者TA水平比较
GD组TG-Ab、TPO-Ab、TRAb与HBV伴发AITD组及单纯AITD组比较,差异有高度统计学意义(P 0.05)。见表2。
2.3 不同甲状腺功能预后CHC患者TA比较
24例AITD患者经停用抗病毒药或进行甲状腺治疗后甲状腺功能有不同转归,恶化组(9例)与缓解组(15例)TA水平比较,TG-Ab差异无统计学意义(P > 0.05);而TPO-Ab、TRAb差异有统计学意义(P 3 讨论
TPO-Ab能通过激活补体和抗体依赖性细胞介导的细胞毒性作用致甲状腺细胞破坏[7]。TRAb对甲状腺有刺激及抑制双重作用,在Graves病中刺激起主要作用,并且其不受机体反馈调节[8-9]。TG-Ab与Tg结合能激话NK细胞而攻击靶细胞,导致甲状腺细胞破坏[11]。三种自身抗体均参与了AITD的发生和致病作用[11]。
AITD是丙型肝炎病毒治疗的相对禁忌证,HCV和IFN-α是诱发AITD的重要原因,有研究显示约40%的CHC患者应用干扰素治疗后会发生甲状腺疾病[12]。HCV患者治疗前及治疗中检测患者自身抗体将对治疗选择和观察具有重要意义[13]。甲状腺自身抗体在HCV相关AITD患者中流行率存在差异,本研究115例应用IFN-α治疗CHC患者诱发AITD 24例(20.9%)与既往研究一致[14-15]。
诸多研究显示不同疾病可能存在特征性自身抗体谱,这些特征性自身抗体及其变化特点作为重要指纹图谱对于该类疾病的临床诊断和指导治疗具有重要价值。HCV相关AITD的TA产生与HCV感染和干扰素使用密切相关[16-22],为此本研究组对HCV诱发HT患者、GD患者与HBV伴发AITD患者、以及单纯AITD患者甲状腺自身抗体水平进行比较。在GD组中除TRAb水平较其余两组明显升高外(P 0.05)。同时在对HCV诱导的HT组与GD组比较中发现,TG-Ab与TPO-Ab在HT患者中升高明显(P CHC导致的AITD患者中恶化患者TPO-Ab、TRAb水平显著高于缓解患者(P 0.05)。因此TPO-Ab和TRAb自身抗体可以作为预后的重要指标。
综上所述,监测甲状腺功能及甲状腺自身免疫性抗体变化在CHC患者INF-α治疗过程中存在较重要意义。并且甲状腺自身抗体在不同种类AITD患者中存在差异,TPO-Ab、TRAb较TG-Ab可能在患者�R床调整治疗方案调整和甲状腺功能预后判断方面更加敏感。
[参考文献]
[1] 中华医学会肝病学分会,中华医学会感染病学分会.丙型肝炎防治指南(2015年更新版)[J].临床肝胆杂志,2015, 3(12):1961-1979.
[2] Gowr E,EstesC,Blach S,et al. Global epidemiology and genotype distribution of the hepatitis C virus infection [J]. Hepatol,2014,61(1):S45-S57.
[3] Bruggmann P,Berg T,Ovrehus A,et al. Historical epidemiology of hepatitis C virus(HCV)in selected countries [J]. Viral Hepat,2014,21(Suppl 1):5-33.
[4] Razavi H,Waked I,Sarrazin C,et al. The present and future disease burden of hepatitis C virus(HCV)infection with Today's treatment paradigm [J]. Viral Hepat,2014,21(Suppl 1):34-59.
[5] 中华医学会内分泌学分会《中国甲状腺疾病诊治指南》编写组.中国甲状腺疾病诊治指南[J].中华内科杂志,2007,46(10):876-882.
[6] 慢性病毒性肝炎患者干扰素α治疗不良反应临床处理专家委员会.慢性病毒性肝炎患者干扰素α治疗不良反应临床处理专家共识[J].中华实验和临床感染病杂志:电子版,2014,8(1):108-113.
[7] Jamil KM,Leedman PJ,Kontorinis N,et al. Interon-induced thyroid dysfunction in chronic hepatitis C [J]. Gastroenterol Hepatol,2009,24(6):1017-1023.
[8] Mandac JC, Chaudhry S,Sherman KE,et al. The clinical and physiological spectrum of interferon-alpha induced thyroiditis: toward a new classification [J]. Hepatology,2006,43(4):661-672.
[9] Nair Kesavachandran C,Haamann F,Nienhaus A,et al. Frequency of thyroid dysfunctions during interferon alpha treatment of single and combination therapy in hepatitis C virus-infected patiwnts: a systematic review based analysis [J]. PLoS One,2013,8(2):355-364. [10] Mcintosh RS,Asghar MS,Weetman AP. The antibody response in human autoimmune thyroid disease [J]. Clin Sci(coloch),1997,9(5):529-541.
[11] 党乐,胡雅婷,张永莉,等.多种抗体检测在甲状腺疾病诊断中的应用价值[J].中国医药导报,2016,13(18):65-68.
[12] 中华医学会检验分会,卫生部临床检验中,中华检验医学杂志编辑委员会.甲状腺疾病诊断治疗中实验室检测项目的应用建议[J].中华检验医学杂志,2012,35(6):484 -492.
[13] 许建彪,杨晓春.甲状腺球蛋白抗体、甲状腺微粒体抗体、甲状腺过氧化物酶抗体研究进展[J].云南医药,2014, 35(40):494-497.
[14] Di Cerbo A,Corda D. Dignaling pathways involved in thyroid hyperfunction and growth in Graves' disease [J]. Biochimie,1999,81(4):415-424.
[15] Cho BY. Clinical applications of TSH receptor antibodies in thyroid diseases [J]. Korean Med Sci,2002,17(2):293-301.
[16] Hsieh MC,Yu ML,Chuang WL,et al. Virologic factorsrelated to interferon-alpha-induced thyroid dysfunction in patients with chronic hepatitis C [J]. Eur J Endocrinol,2000,142(12):431-437.
[17] Broussolle C,Steineur MP, Bailly F,et al. Hepatitis C virus infection and thyroid diseases [J]. Rev Med Interne. 1999,20(32):766-773.
[18] Carella C,Mazziotti G,Morisco F,et al. Long-term outcomeof interferon-alpha-induced thyroid autoimmunity and prognostic influence of thyroid autoantibody pattern at the end of treatment [J]. Clin Endocrinol Metab.2001,86(5):1925-1929.
[19] Fernandez-Soto L,Gonzalez A,Escobar-Jimenez F,et al. Increased risk of autoimmune thyroid disease in hepatitis C vs hepatitis B before,during,and after discontinuing interferon therapy [J]. Arch Intern Med,1998,158(45):1445-1448.
[20] Deutsch M,Dourakis S,Manesis EK,et al. Thyroid abnormalities in chronic viral hepatitis and their relationship to interferon alfa therapy [J]. Hepatology,1997,26(3):206-210.
[21] ��琰,何煜,龚俊,等.Graves病肝损害与甲状腺功能及免疫因素的关系[J].中国医药导报,2015,12(34):56-59.
[22] Marazuela M,García-Buey L,González-Fernández B,et al. Thyroid autoimmune disorders in patients with chronic hepatitis C before and during interferon-alpha therapy [J]. Clin Endocrinol (Oxf),1996,44(32):635-642.
 爱华网
爱华网