本文总结了高考化学“有机化学“部分中的方法规律以及知识点。
第一:有机化学中的方法规律
1.有机物同分异构体的书写方法
〖碳链异构的书写方法〗以己烷(
)为例,共五种同分异构体(氢原子省略)
(1)先直链、一条线
(2)摘一碳、挂中间、往边移、不到端
(3)摘两碳、二甲基、同邻间、不重复、要写全
如果碳链更长,还可以摘两碳、三碳,先甲基,后乙基……
〖取代基位置异构的书写方法〗
1、对称法(等效氢法)
a、同一碳原子上的氢原子是等效的;b、同一碳原子所连甲基上的氢原子是等效的;c、处于镜面对称位置上的氢原子是等效的
2、换元法
详解:同分异构体书写规律:遵循对称性、有序性原则,一般按照下列顺序书写:官能团类型异构;碳链异构;官能团或取代基位置异构;立体异构(较少涉及)
口诀:主链长到短,支链整到散,位置心到边,排布对邻间
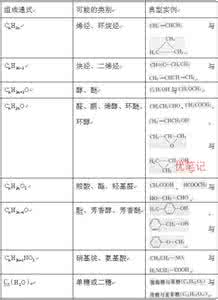
2.有机物类型异构大全
3.常见有机物的分离提纯方法
4.常见有机物的检验与鉴别
第二:有机化学知识点总结
1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解 (5)、酚醛树脂的制取(6)固体溶解度的测定 凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
2.需用温度计的实验有:(1)、实验室制乙烯(170℃) (2)、蒸馏 (3)、固体溶解度的测定 (4)、乙酸乙酯的水解(70-80℃) (5)、中和热的测定 (6)制硝基苯(50-60℃)
〔说明〕:(1)凡需要准确控制温度者均需用温度计。(2)注意温度计水银球的位置。
3.能与Na反应的有机物有:醇、酚、羧酸等——凡含羟基的化合物。
4.能发生银镜反应的物质有: 醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖——凡含醛基的物质。
5.能使高锰酸钾酸性溶液褪色的物质有:(1)含有碳碳双键、碳碳叁键的烃和烃的衍生物、苯的同系物 (2)含有羟基的化合物如醇和酚类物质 (3)含有醛基的化合物 (4)具有还原性的无机物(如SO2、FeSO4、KI、HCl、H2O2等)
6.能使溴水褪色的物质有:(1)含有碳碳双键和碳碳叁键的烃和烃的衍生物(加成); (2)苯酚等酚类物质(取代) ;(3)含醛基物质(氧化); (4)碱性物质(如NaOH、Na2CO3)(氧化还原――歧化反应); (5)较强的无机还原剂(如SO2、KI、FeSO4等)(氧化) ; (6)有机溶剂(如苯和苯的同系物、四氯甲烷、汽油、已烷等,属于萃取,使水层褪色而有机层呈橙红色。)
7.密度比水大的液体有机物有:溴乙烷、溴苯、硝基苯、四氯化碳等。
8、密度比水小的液体有机物有:烃、大多数酯、一氯烷烃。
9.能发生水解反应的物质有:卤代烃、酯(油脂)、二糖、多糖、蛋白质(肽)、盐。
10.不溶于水的有机物有:烃、卤代烃、酯、淀粉、纤维素
11.常温下为气体的有机物有:分子中含有碳原子数小于或等于4的烃(新戊烷例外)、一氯甲烷、甲醛。
12.浓硫酸、加热条件下发生的反应有:苯及苯的同系物的硝化、磺化、醇的脱水反应、酯化反应、纤维素的水解
13.能被氧化的物质有:含有碳碳双键或碳碳叁键的不饱和化合物(KMnO4)、苯的同系物、醇、醛、酚。 大多数有机物都可以燃烧,燃烧都是被氧气氧化。
14.显酸性的有机物有:含有酚羟基和羧基的化合物。
15.能使蛋白质变性的物质有:强酸、强碱、重金属盐、甲醛、苯酚、强氧化剂、浓的酒精、双氧水、碘酒、三氯乙酸等。
16.既能与酸又能与碱反应的有机物:具有酸、碱双官能团的有机物(氨基酸、蛋白质等)
17.能与NaOH溶液发生反应的有机物:(1)酚: (2)羧酸: (3)卤代烃(水溶液:水解;醇溶液:消去) (4)酯:(水解,不加热反应慢,加热反应快) (5)蛋白质(水解)
18、有明显颜色变化的有机反应:(( 1).苯酚与三氯化铁溶液反应呈紫色; (2).KMnO4酸性溶液的褪色; (3).溴水的褪色;(4).淀粉遇碘单质变蓝色 ; ( 5).蛋白质遇浓硝酸呈黄色 颜色反应 。
 爱华网
爱华网