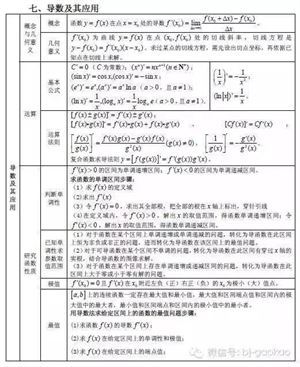
作为基础学科知识内容考查的依据,以下所列的知识点在近10年来的化学高考命题中呈现率达90%以上希望同学们在临考的复习中能一一对照来巩固相应的基础,如果某些点的认识不够,建议重温相应的教材和教辅资料,确保该内容的高得分率。
1、 氧化还原相关概念和应用(1) 借用熟悉的H2还原CuO来认识5对相应概念 2) 氧化性、还原性的相互比较(3) 氧化还原方程式的书写及配平4) 同种元素变价的氧化还原反应(歧化、归中反应)(5) 一些特殊价态的微粒如H、Cu、Cl、Fe、S2O32-的氧化还原反应
(6) 电化学中的氧化还原反应
2、 物质结构、元素周期表的认识(1) 主族元素的阴离子、阳离子、核外电子排布(2) 同周期、同主族原子的半径大小比较(3) 电子式的正确书写、化学键存在
(4) 建议能画出短周期元素周期表的草表

3、 阿氏常数与阿氏定律(1) 利用克拉伯龙方程推导“阿氏4推论”,(P、V、T)条件下对“物质的量、摩尔质量、微粒数、体积比、密度比”(2) 利用克拉伯龙方程计算不同温度或压强下的体积
(3) 熟悉NA常考查的微粒数目中固体、得失电子、中子数等内容。
4、 化学能量(1) 今年该内容被独立地罗列于考试说明中,请多加注意(2) 热化学方程式的正确表达(状态、计量数、能量关系)
(3) 化学变化中的能量交换关系
5、 离子的鉴别、离子共存(1) 离子因结合生成沉淀而不能大量共存(2) 因能反应生成气体而不能大量共存(3) 因能生成难电离的弱电解质(4) 因相互发生氧化还原而不能大量共存(5) 因双水解、生成络合物而不能大量共存(6) 弱酸的酸式酸根离子不能与强酸、强碱大量共存
(7) 题设中的“酸碱性、颜色”等
6、 溶液浓度、离子浓度的比较及计算(1) 善用微粒的守恒判断(2) 电荷守恒中的多价态离子处理(3) 物料守恒中离子与水解产物的综合考虑
(4) 浓度的计算请遵循定义(公式)规范表达
7、 pH值的计算(1) 遵循定义(公式)规范自己的计算过程(2) 理清题设所问的是“离子”还是“溶液”的浓度
(3) 酸过量或碱过量时pH的计算(酸时以H浓度计算,碱时以OH计算再换算)。
8、 化学反应速度、化学平衡(1) 能计算反应速率、理解各物质计量数与反应速率的关系(2) 以“高则快”,“低则慢”来理解条件对反应速率的影响(3) 理顺“反应速率”的“改变”与“平衡移动”的“辩证关系”(4) 遵循反应方程式规范自己的“化学平衡”相关计算过程
(5) 平衡移动中的“等效平衡”理解(难点)
9、 电化学(1) 以家庭里的干电池为参照物理顺“电极名称”(2) 能正确表明“原电池、电解电镀池”及变形装置的电极位置(3) 能写出各电极的电极反应方程式(4) 了解常见离子的电化学放电顺序
(5) 能准确利用“得失电子守恒”原则计算电化学中的定量关系
10、 盐类的水解(1) 盐类能发生水解的原因(2) 不同类型之盐类发生水解的后果(酸碱性、浓度大小等)(3) 盐类水解的应用或防止(胶体、水净化、溶液制备)(4) 对能发生水解的盐类溶液加热蒸干、灼烧的后果
(5) 能发生完全双水解的离子反应方程式
11、Cl、S、N、X、P、Na、Mg、Al、Fe等元素的单质及化合物(1) 总体上借助价态变化的转化反应来认识(2) 容易在无机推断题中出现,注意上述元素的特征反应(3) 注意N中的硝酸与物质的反应,其体现的酸性、氧化性“两作为”是考查的的重点(4) 有关Al的化合物中则熟悉其两性反应(定性、定量关系)
(5) 有关Fe的化合物则理解Fe2+和Fe3+之间的转化、Fe3+的强氧化性
12、有机物的聚合及单体的推断(1) 根据高分子的链节特点准确判断加聚反应或缩聚反应归属(2) 熟悉含C=C双键物质的加聚反应或缩聚反应归属
(3) 熟悉含(-COOH、-OH)、(-COOH、-NH2)、酚醛之间的缩聚反应
13、同分异构体的书写(1) 该内容的作答并不难,相信自己能很好地完成(2) 请按官能团的位置异构、类别异构和条件限制异构顺序一个不漏的找齐
(3) 本内容最应该做的是作答后,能主动进行一定的检验
14、有机物的燃烧(1) 能写出有机物燃烧的通式
(2) 燃烧最可能获得的是C和H关系
15、完成有机反应的化学方程式(1) 有机化学推断题中,往往要求完成相互转化的方程式
(2) 注意方程式中要求表示物质的结构简式、表明反应条件、配平方程式
16、有机物化学推断的解答(1)一般出现以醇为中心,酯为结尾的推断关系,所以复习时就熟悉有关“醇”和“酯”的性质反应(包括一些含其他官能团的醇类和酯)(2) 反应条件体现了有机化学的特点,请同学们回顾有机化学的一般条件,从中归纳相应信息,可作为推断有机反应的有利证据(3) 从物质发生反应前后的官能团差别,推导相关物质的结构
17、化学计算(1) 近年来,混合物的计算所占的比例很大(90%),务必熟悉有关混合物计算的一般方式(含讨论的切入点)(2) 回顾近 几次综合考试的计算题,感受“守恒法“在计算题干中的暗示和具体计算时的优势
百度搜索“爱华网”,专业资料,生活学习,尽在爱华网!
爱华网本文地址 » http://www.aihuau.com/a/384751/42980364566.html

 爱华网
爱华网