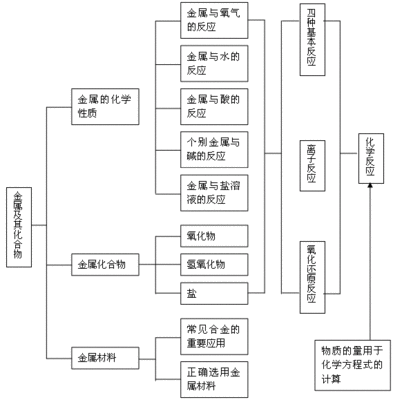
一、钠及其化合物
1. 钠与酸反应时,先于酸反应,酸不足再与水反应。
2. 钠与盐的溶液时,钠不能置换出溶液中的金属,是钠直接与水反应,反应后生成的碱再与溶液中的物质反应。
3. 等物质的量的金属钠与氧气作用生成Na2O和Na2O2时,转移的电子数相同。
4. Na2O2与CO2或H2O反应时,生成1 mol O2,转移的电子的物质的量均为2 mol。
5. Na2O2与CO2和水蒸气组成的混合气体反应时,应先考虑Na2O2与CO2反应。因为若先发生反应:Na2O2 + 2H2O === 4NaOH + O2↑,必定还会发生:4NaOH + CO2 === Na2CO3 + H2O的反应。
6. Na2O2与SO2反应的化学方程式为:Na2O2 + SO2 === Na2SO4。
7. 向Na2CO3溶液中逐滴滴入盐酸,反应是分步进行的,反应的离子方程式依次为:CO32-+ H+ === HCO3-、HCO3-+ H+ === H2O + CO2↑。
二、镁、铝及其化合物
1. 镁在空气中燃烧的化学方程式有:Mg + O22MgO、3Mg + N2 Mg3N2、2Mg + CO2 2MgO + C。
2. Mg3N2与水反应:Mg3N2 + 6H2O === 3Mg(OH)2 + 2NH3↑。
3. 加热Mg(HCO3)2溶液生成的是Mg(OH)2沉淀,而不是MgCO3沉淀,因为Mg(OH)2比MgCO3更难溶于水。反应方程式为:Mg(HCO3)2 Mg(OH)2↓+ 2CO2↑。
4. 铝与氢氧化钠溶液、非氧化性强酸反应生成H2。常温下,浓硝酸、浓硫酸使铝发生钝化。
5. Al2O3、Al(OH)3仅能溶于强酸和强碱溶液中(如在碳酸和氨水中不溶)。
6. Al3+、AlO2-只能存在于酸性、碱性溶液中。Al3+ 与下列离子不能大量共存:OH-、S2-、SO32-、HCO3-、CO32-、ClO-、AlO2-,其中OH-是因为直接反应,其余均是因为发生剧烈的双水解反应。AlO2-与下列离子不能大量共存:H+、HCO3-、Al3+、Fe2+、Fe3+,其中H+与HCO3-是因为与AlO2-直接反应(AlO2-+ HCO3-+ H2O === Al(OH)3↓+ CO32-),其余也是因为发生了剧烈的双水解反应。
7. 明矾的净水原理:明矾的化学式为:KAl(SO4)2·12H2O,它在水中能电离:KAl(SO4)2·12H2O === K+ + Al3+ + 2SO42- + 12H2O。铝离子发生水解反应,生成氢氧化铝胶体具有很强的吸附能力,吸附水中的悬浮物,使之沉降以达到净水目的:
Al3+ + 3H2O === Al(OH)3(胶体)+ 3H+。
三、铁、铜及其化合物
1. Fe不能与冷、热水反应,但能与水蒸气在高温下反应生成H2和Fe3O4,而不是Fe2O3。
2. Fe与Cl2反应只能生成FeCl3,与S、I2反应分别生成的是FeS、FeI2,与反应物的用量无关。
3. 过量的Fe与硝酸作用,或在Fe和Fe2O3的混合物中加入盐酸均有Fe2+ 生成。因为还存在生成的Fe3+ 继续氧化单质Fe这一隐含反应:
2Fe3+ + Fe === 3Fe2+。
4. Fe2+与NO3-在酸性条件下不能共存。
5. Fe2O3、Fe(OH)3与氢碘酸反应时,涉及Fe3+与I-的氧化还原反应,产物为Fe2+、I2和H2O。
6. FeCl3溶液加热浓缩时,因Fe3+水解和HCl的挥发,得到的固体为Fe(OH)3,灼烧后得到红棕色Fe2O3固体;而Fe2(SO4)3溶液蒸干时,因硫酸是难挥发性的酸,将得不到Fe(OH)3固体,最后得到的固体仍为Fe2(SO4)3。
7. 注意亚铁盐及Fe(OH)2易被空气中氧气氧化成三价铁的化合物。如某溶液中加入碱溶液后,最终得到红褐色沉淀,并不能断定该溶液中一定含有Fe3+ ,也可能含有Fe2+。
8. 铜在潮湿的空气中锈蚀,生成碱式碳酸铜。俗称铜绿:2Cu + CO2 + H2O + O2 === Cu2(OH)2CO3。铜离子与氨水的反应:
Cu2+ + 2NH3·H2O=== Cu(OH)2↓+ 2NH4+ (氨水少量时),Cu(OH)2 + 4NH3 === 2OH-+ [Cu(NH3)4]2+ (深蓝色溶液)(氨水足量时)。
9. Cu2+和H2S、HS-、S2-反应
虽然Cu2+具有一定的氧化性,但和H2S、HS-、S2-发生离子反应生成沉淀,而不是发生氧化还原反应,Cu2+ + H2S === CuS↓+ 2H+。
10. Cu2+还能和具有还原性的金属反应:Cu2+ + Fe === Cu + Fe2+
11. 氧化铜和还原剂的反应:CuO + CO Cu + CO2;3CuO + 2NH3 3Cu + N2 + 3H2O;
CH3CH2OH + CuO CH3CHO + Cu+ H2O
四、考题欣赏
【例题1】(2011广东高考)某同学通过系列实验探究Mg及其化合物的性质,操作正确且能达到目的的是
A. 将水加入浓硫酸中得到稀硫酸,置镁片于其中探究讨Mg的活泼性
B. 将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成
C. 将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
D. 将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体
解析:本题考察镁及其化合物的性质、常见的基本实验操作。稀释浓硫酸时,应将浓硫酸沿着器壁慢慢加入水中,并及时搅拌,A是错误的;过滤时需要用玻璃棒引流,因此C不正确;蒸发溶液时应该用蒸发皿而不是表面皿,由MgCl2水解,所以加热时必需在HCl的气氛中加热才能得到MgCl2固体,所以D不正确。因此只有选项B是正确的。
答案:B
【例题2】(2011山东高考)Al、Fe、Cu都是重要的金属元素。下列说法正确的是
A. 三者对应的氧化物均为碱性氧化物
B. 三者的单质放置在空气中均只生成氧化物
C. 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
D. 电解AlCl3、FeCl3、CuCl2的混合溶液是阴极上依次析出Cu、Fe、Al
解析:铝对应的氧化物Al2O3属于两性氧化物,A不正确;铝属于活泼金属其表面易被空气中氧气氧化形成一层致密的氧化膜而使铝不易被腐蚀;铁放置在空气可以直接发生化学腐蚀,例如铁与氯气直接反应而被腐蚀;铜放置在空气中会和空气中氧气、二氧化碳和水缓慢的反应生成碱式碳酸铜即铜绿,方程式为2Cu + O2 + CO2 + H2O === Cu2(OH)2CO3,因此选项B不正确;AlCl3、FeCl3、CuCl2均属于强酸弱碱盐,在溶液中会水解生成相应的氢氧化物和HCl,溶液在加热时会促进水解,同时生成的HCl挥发,进一步促进水解,当溶液蒸干后将最终将得到相应的氢氧化物或氧化物,所以选项C正确;铝属于活泼的金属元素,在水溶液中Al3+不会放电生成铝单质;Fe3+在水溶液会放电但产物是Fe2+,而不是单质铁;只有Cu2+在阴极上得到电子生成单质铜。所以选项D也不正确。
答案:C
【例题3】(2011年海南高考)铜(Cu)是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为_______;
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是_______;
(3)SO42-的立体构型是________,其中S原子的杂化轨道类型是_______;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_____;该晶体中,原子之间的作用力是_____;
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为______。
解析:本题各小题内容考查点相互的联系不大,仍属于“拼盘”式题。(3)硫酸根中心原子的价层电子对为:孤对电子数6-2×4+2=0,成键电子对数4,所以为正四面体结构,中心原子为sp3杂化;(4)Au电子排布或类比Cu,只是电子层多两层,由于是面心立方,晶胞内N(Cu)=6×1/2=3,N(Au)=8×1/8=1;(5)CaF2结构如下图所示,所以氢原子在晶胞内有4个,可得储氢后的化学式为H8AuCu3
答案:(1)Cu+2 H2SO4(浓) CuSO4 + SO2↑+ 2H2O;
(2)白色无水硫酸铜可与水结合生成蓝色的CuSO4·5 H2O,显示水合铜离子特征蓝色;
(3)正四面体,sp3;(4)6s1;(5)3:1;(4)金属键;(5)H8AuCu3
2013-03-11 人教网 下载: 爱华网
爱华网