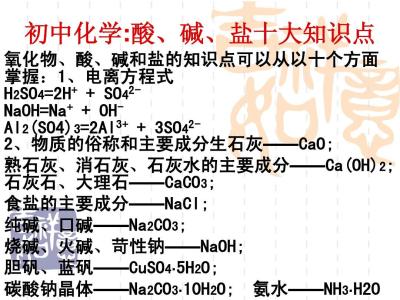
1. 原子核不一定都是由质子和中子构成的。如氢的同位素氕中只有一个质子。
2. 酸性氧化物不一定都是非金属氧化物。如酸性氧化物Mn2O7是金属氧化物。
3. 非金属氧化物不一定都是酸性氧化物。如CO、NO等都不能与碱反应,是不成盐氧化物。
4. 金属氧化物不一定都是碱性氧化物。如Mn2O7是酸性氧化物,Al2O3是两性氧化物,Na2O2是过氧化物。
5. 由同种元素组成的物质不一定是单质。如金刚石与石墨均由碳元素组成,二者混合所得的物质是混合物。
6. 晶体中含有阳离子不一定含有阴离子。如金属晶体中含有金属阳离子和自由电子,而无阴离子。
7. 有单质参加或生成的化学反应不一定是氧化还原反应。如金刚石→石墨,同素异形体间的转化因反应前后均为单质,元素的化合价没有变化,是非氧化还原反应。
8. 离子化合物中不一定含有金属离子。如NH4Cl属于离子化合物,其中不含金属离子。
9. pH=7的溶液不一定是中性溶液。只有在常温时水的离子积=1×10-14,此时pH=7的溶液才呈中性。
10. 用pH试纸测溶液的pH时,试纸用蒸馏水润湿,测得溶液的pH不一定有误差,如所测溶液为中性溶液。
11. 分子晶体中不一定含有共价键。如稀有气体在固态时均为分子晶体,不含共价键。
12. 能使品红溶液褪色的气体不一定是SO2,如Cl2、O3均能使品红溶液褪色。
13. 金属阳离子被还原不一定得到金属单质。如Fe3+可被还原为Fe2+。
14. 某元素由化合态变为游离态时,该元素不一定被还原。如2H2O=2H2↑+O2↑,氢元素被还原而氧元素被氧化。
15. 强氧化物与强还原剂不一定能发生氧化还原反应。如浓硫酸是常见的强氧化剂,氢气是常见的还原剂,但可用浓硫酸干燥氢气,因二者不发生反应。
16. 放热反应在常温下不一定很容易发生,吸热反应在常温下不一定不能发生。如碳与氧气的反应为放热反应,但须点燃反应才能发生;Ba(OH)2·8H2O与NH4Cl反应为吸热反应,但在常温下很容易发生。
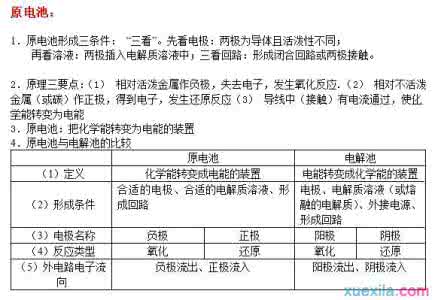
17. 含金属元素的离子不一定都是阳离子。如AlO2-。
18. 原子最外层电子数大于4的元素不一定是非金属元素。如周期表中ⅣA、ⅤA、ⅥA中的金属元素原子最外层电子数均多于4个。
19. 不能在强酸性溶液中大量存在的离子,不一定能在强碱性溶液中大量存在。如HCO3-、HS-等既不能在强酸性溶液中大量存在,也不能在强碱性溶液中大量存在。
20. 组成和结构相似的物质,相对分子质量越大,熔沸点不一定越高。一般情况下该结论是正确的,但因H2O、HF、NH3等分子间能形成氢键,熔沸点均比同主族元素的氢化物的高。
21. 只由非金属元素组成的晶体不一定属于分子晶体。如NH4Cl属于离子晶体。
22. 只含有极性键的分子不一定是极性分子。如CCl4、CO2等都是含有极性键的非极性分子。
23. 铁与强氧化性酸反应不一定生成三价铁的化合物。如铁与硝酸反应,若铁过量则生成亚铁离子。
24. 具有金属光泽并能导电的单质不一定是金属。如石墨具有金属光泽,但属于非金属单质。
25. 失去电子难的原子得到电子的能力不一定强。如稀有气体原子既不易失去电子也不易得到电子。
26. 浓溶液不一定是饱和溶液,饱和溶液不一定是浓溶液。如KNO3的浓溶液不一定是饱和溶液,因KNO3的溶解度较大;Ca(OH)2的饱和溶液不是浓溶液,因Ca(OH)2微溶于水。
27. 强电解质溶液的导电能力不一定强。导电性的强弱与溶液中自由离子的浓度大小有关,如果某强电解质溶液的浓度很小,那么它的导电性可以很弱,而某弱电解质虽然电离程度小,但如果离子浓度大时,该溶液的导电能力也可以较强。
28. 弱电解质溶液被稀释时,离子浓度不一定减小。如冰醋酸在稀释时,H+、CH3COO-浓度先逐渐增大而后减小。
29. 平衡向正反应方向移动,反应物的转化率不一定增大。如有两种反应物的反应,增大一种反应物的浓度,平衡正向移动,另一种反应物的转化率增大,自身的转化率减小。
30. 1 mol某气体的体积是22.4 L,该气体所处的状态不一定是标准状况。由pV=nRT可知V=nRT/p,受诸多因素的影响
 爱华网
爱华网