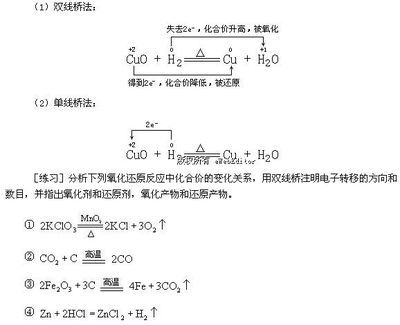
电子得失守恒规律是指在任何氧化还原反应中,氧化剂得到电子的数目与还原剂失去电子的数目相等。由于氧化还原反应中氧化剂和还原剂元素种类和数目的复杂性,使电子守恒关系式具有一定的灵活性和难度。在高考命题中,用得失电子守恒法求解的题型有确定氧化剂、还原剂、氧化产物和还原产物的量的多少或量的比例,确定氧化剂、还原剂、氧化产物或还原产物中元素的价态或种类,有关电化学及其他有关氧化还原反应的计算等。
一、电子守恒法的解题原理
在氧化还原反应中,元素得失电子数目是守恒的,利用得失电子守恒来建立等式是快速解决氧化还原反应计算题的基本方法。在利用电子守恒法解题时,一般分为三个步骤:①找出氧化剂和还原剂以及各自的还原产物和氧化产物,②找准1个原子或离子得失电子数(注意:化学式中粒子的个数),③由题中物质的物质的量,根据电子守恒列等式:n(氧化剂)×变价原子个数×化合价变化值=n(还原剂)×变价原子个数×化合价变化值。
二、利用电子守恒解常见题型的方法
1、简单反应的电子得失守恒问题
在任何一个氧化还原反应中电子得失总是相等的,解这类问题的关键是找出还原剂(或氧化产物)中被氧化的元素以及氧化剂(或还原产物)中被还原的元素,然后从元素化合价升高(降低)确定失(得)电子的总数。根据氧化剂得电子总数与还原剂失电子总数相等求解,这种题型除了可以确定化学式和化合价外,还可以确定具体的氧化产物和还原产物、氧化剂和还原剂及它们的比值。
【例1】(2011·大纲版全国卷)某含铬Cr2O72-废水用硫亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到nmolFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是
A.消耗硫酸亚铁铵的物质的量为n(2-x)mol
B.处理废水中Cr2O72-的物质的量为mol
C.反应中发生转移的电子为3nx mol
D.在FeO·FeyCrxO3中3x=y
解析:该反应中铁元素的化合价由+2升高到+3,铬元素的化合价由+6降到+3。由铬元素守恒知废水中Cr2O72-的物质的量为mol,反应中转移的电子为6×mol =3nxmol。由得失电子守恒知y=3x,而由铁元素守恒知消耗硫酸亚铁铵的物质的量为n×(1+y)mol=n(3x+1)mol,因此选项A是错误的。答案:A
2.电化学中的电子得失守恒问题
电化学反应就是氧化还原反应。在电解池中,阳极失电子数目与阴极得电子数目一定相等。在原电池中,负极失电子数目与正极得电子数目也一定相等。无论是电解池还是原电池,在进行计算时均可以依据这个原则列出等式求解。这类试题可以求解电解后某物质溶液浓度的变化,也可以求解析出物质的质量或气体的体积,还可以求解加入物质恢复原浓度需要的质量,但最本质的一点是要遵循电子守恒规律。
【例2】一烧杯中盛有一定量的硫酸钠饱和溶液,将两根铜电极插入该溶液中进行电解。当阴极逸出amol气体,烧杯中有W gNa2SO4·10H2O析出,保持温度不变,此时剩余溶液中硫酸钠的质量分数是 。
【解析】因铜是活性电极,故阳极反应为Cu-2e-=Cu2+,阴极反应为2H++2e-=H2↑,总反应为,阳极失电子数目与阴极得电子数目相等。阴极逸出amol H2,被电解的水为2amol。因为被电解的水和析出的Na2SO4·10H2O的组成仍为饱和溶液,则剩余硫酸钠溶液的质量分数可以从被电解的水和析出的Na2SO4·10H2O来求解,剩余溶液中硫酸钠的质量分数为=[(142W/322)/(W+36a)]×100%=。值得一提的是如果将本题改为将两根惰性电极插入该溶液中进行电解,则根据电子守恒得硫酸钠的质量分数为答案:
3、多元素参与反应的电子得失守恒问题
某些氧化还原反应中组成氧化剂或还原剂的元素种类超过一种,这类氧化还原反应具有复杂性。它可以是两种元素氧化一种元素、一种元素氧化两种元素、或二种元素氧化二种元素等。这种题型的解法,不要被表面现象迷惑,一定用认真分析氧化剂和还原剂所对应的元素,一定要明确题意指定的对象哪种元素氧化哪种元素,根据题意用电子守恒解题才能不出差错。
【例3】在P+CuSO4+H2O →Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5mol CuSO4可氧化P的物质的量为 mol。生成1 mol Cu3P 时,参加反应的P的物质的量为 mol。
【解析】该反应的氧化剂为P、CuSO4,还原剂为P,本题强调CuSO4氧化P的物质的量,设7.5mol CuSO4氧化P的物质的量为xmol,P被氧化为H3PO4。由电子守恒得7.5×(2-1)=x×(5-0),x=1.5 。生成1 mol Cu3P时,氧化剂共得电子3×1+1×3=6(mol)。根据电子得失守恒知P被氧化时失去的电子为6mol,则作还原剂的P的物质的量为6/5=1.2(mol),所以参加反应的P的物质的量为1.2+1=2.2(mol)。答案:1.5 2.2
4、微粒先后反应时电子守恒的问题
当一种物质同时氧化两种以上的微粒时,则强还原剂先被氧化。一种物质同时还原两种以上微粒时,则强氧化剂先被还原。被氧化和被还原到何种程度,要以还原剂和氧化剂的物质的量多少来决定,具体计算时用电子守恒规律,但是对氧化还原反应过程中对应的每个阶段要分析清楚,电子守恒在对应的阶段同样适用。
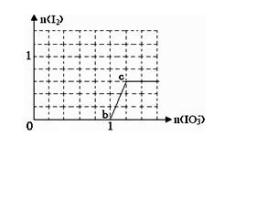
【例4】下列微粒在溶液中的还原性和氧化性强弱如下:还原性HSO3ˉ>Iˉ,氧化性IO3ˉ>I2>SO42-。在含有xmolNaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如图所示,则x= mol。
【解析】开始加入KIO3溶液时,最先与IO3ˉ反应的微粒是HSO3ˉ,其还原产物为Iˉ,氧化产物为SO42-。当HSO3ˉ反应完后,b点到c点发生反应的离子方程式为IO3ˉ+5Iˉ+6H+=3I2+3H2O。所以0点到b点参加反应的HSO3ˉ的物质的量可利用电子守恒求解,n(HSO3ˉ)×2=1mol×6,所以x= 3 mol
答案:3
5. 多步反应电子得失守恒问题
有的试题反应过程多,涉及的氧化还原反应也多,数量关系较为复杂,若用常规方法求解和化学方程式求解比较困难,若抓住失电子总数等于得电子总数这一关系,则解题就变得很简单。解这类试题时,注意不要遗漏某个氧化还原反应,要理清具体的反应过程,分析在整个反应过程中化合价发生变化的元素得电子数目和失电子数目。
【例5】现有铁粉和氧化铁的混合物共27.2 g,加入足量的稀硫酸使之充分反应。当固体粉末完全溶解时,收集到2.24L(标准状况下)气体,当向溶液中滴加KSCN溶液时,溶液不显血红色。试求原样品中氧化铁的质量分数。
解析:设Fe2O3的物质的量为xmol,由电子得失守恒关系有:n(Fe)×2=n(Fe2O3)×2+n(H2)×2。即(27.2-160x)÷56=x+(2.24/22.4),解得x=0.1,则氧化铁的质量分数为(0.1mol×160g/mol÷27.2 g)×100%≈58.8%。
总之,有关氧化还原反应计算问题的核心就是利用得失电子守恒来建立等式,准确找到化合价发生变化的元素得失电子的数目,并利用此关系式是解这类问题的关键。巧妙运用电子守恒法可以快速、准确地解决问题,提高解决问题的能力。
 爱华网
爱华网