题目:烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g。某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入10%的NaOH溶液,得到沉淀的质量记录如下:
加入NaOH溶液的质量/g
50.0
100.0
150.0
200.1
250.0
生成沉淀的质量/g
0.0
2.5
8.6
9.8
9.8
(1)得到沉淀的总质量为 g,该混合溶液中硫酸铜的质量为 g。
(2)参加反应的NaOH溶液的总质量是多少克?(要求写出计算过程)
上面题目是近期中考复习中,学生考过的一道计算题。查卷发现(2)小题的做法所有学生思维一边倒,没有一位学生采用独特的新颖的思维方法去完成。在深感遗憾之余让我不得不想法设法去进一步培养学生对数据的利用处理能力,深化他们的解题思维。
一、思维一级深化
先呈现学生解决(2)小题时在相同思维下的解题过程:
解法一
上面的解法思路虽然比较清晰:“跟硫酸反应的NaOH溶液的质量+跟硫酸铜反应的NaOH溶液的质量=参加反应的NaOH溶液的总质量”,但解题过程繁杂。是否有更方便快捷的方法?
老师设疑:如果把该题题干中“已知该溶液中含H2SO4的质量为9.8 g”这个条件去掉,大家是否也能正确算出参加反应的NaOH溶液总质量?(设问目的:促使学生竭尽全力去思考全新的解题思路)
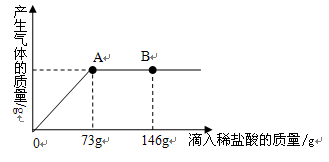
师生分析研究获得新思路:分析表格数据可知,参加反应的氢氧化钠溶液的总质量应该介于150.0g~200.1g之间(氢氧化钠溶液质量为200.1g时,实际已经过量了),那么到底当沉淀由8.5增加到9.8g时,参加反应的氢氧化钠溶液的总质量应该由150.0g再继续反应多少质量就可以满足恰好生成9.8g沉淀?
解法二

二、思维二级深化
上面两种做法两相对比,学生无不受到新的思维撞击而鼓掌叫好!老师趁着学生热情高涨时候继续提问:解法二的最终结果如果不进行近似处理,结果是159.84g,为什么跟第一种解法的结果相差0.16g?如果为了鼓励大家的创新精神和能力,假如你是命题者,表中的8.6g这个数据你该如修改,就能使到两种解法的结果尽可能保持一致?这两个问题,第一个问题是引子,可不必多加讨论,第二个问题才是思维二级深化的重点,它引导学生去修改数据,该问题的解决能更进一步培养学生数据的处理和利用能力,同时也能让学生体验一下试题设计的乐趣。
总结和收获:本文通过一道化学计算题的繁杂解法,来引导学生用新思路解决问题,然后引导学生修改该计算题中不太严密的数据,让学生在利用和处理表格数据的能力得以进一步的培养,同时也让学生进一步意识到很多化学计算题往往有“易想难做,难想易做”的特点,以后要力争创新求解。
 爱华网
爱华网