糖尿病现在在我们的生活中已经是一种非常常见的老年人容易患有的疾病了,而最令人们担心的就是糖尿病肾病这种并发症了,因为它对患者的生命是有一定的威胁的。
糖尿病肾病(diabetic nephropathy,DN)为糖尿病性微血管病变所引起,早期表现为尿中排出微量白蛋白。继之出现临床蛋白尿,最后发展为慢性肾功能不全。终末期肾病是老年人糖尿病引起死亡的主要原因。
老人糖尿病_老年人糖尿病肾病 -流行病学
DN发病除了代谢长期失控的原因以外,还受遗传因素等的影响,故DN的发病率受多种因素的影响,并非所有的糖尿病都将发展为肾病,约40%糖尿病患者最终进展为肾病。最近发现高血压倾向,DN家族史,心血管疾病家族史与IDDM肾病的发生有关。IDDM合并的肾病年发病率随病程延长而增高,至病程20年时达高峰,而于30年后发病急剧下降大多数IDDM终身不发展为肾病,部分病人尽管长期血糖控制不良亦不发生肾病。大多数有微量白蛋白尿的IDDM患者在以后的5~10年内进展为明确的肾病。
在NIDDM中,出现微量白蛋白尿的确切意义不能马上确定。伴视网膜病变的Ⅱ型糖尿病患者持续白蛋白尿的主要原因为糖尿病性肾小球硬化而无视网膜病变的患者中糖尿病与非糖尿病肾病变约各占50%在病程为20年的NIDDM患者,DM患病率为25%。
老年人中DN发生率较高,估计老年NIDDM伴慢性肾功能不全者为IDDM的8倍研究表明微量白蛋白尿是预测老年NIDDM患者长期死亡率的最好指标。
大多数伴有蛋白尿的IDDM会提前死于心血管并发症,与不伴蛋白尿的糖尿病相比伴有蛋白尿的糖尿病患者死于心血管病的危险性增加20~40倍近年认为IDDM中蛋白尿与肾病和肾衰竭关系密切而NIDDM中蛋白尿与心血管病变的关系较肾病更为密切。因此,2种类型蛋白尿的临床意义不同。
病因
现已明确,糖尿病肾病的发生、发展是多种因素缩合作用所致。糖代谢紊乱,肾血流动力学异常,多种活性细胞因子以及遗传因素等在本病的发生中均有重要作用。
老人糖尿病_老年人糖尿病肾病 -发病机制
1.发病机制
(1)遗传:长期以来,人们在注意到血糖长期失控易并发肾脏病变等各种慢性并发症的同时亦发现以下一些事实,提示可能存在着遗传因素的影响。
尽管40%~50%的IDDM患者最终可发生明显的临床肾病,但仍有半数以上的患者不管血糖控制如何终身不发生肾病这种异质性不能用代谢调节的差异来解释。IDDM新病例年发病率在病程20年左右达到最高峰而病程30年后呈急剧下降态势。
DN的发生和发展与病程及代谢控制程度缺乏一致性部分糖尿病病人尽管长期血糖失控从不会发生肾病而约5%的糖尿病病人在发病短期尽管血糖控制良好,却发生严重的DN
①ACE基因遗传多态与DN:已经明确血管紧张素I转换酶(ACE)基因第16内含子上一段287bp插入/缺失(I/D)多态与冠心病发病有关,基因型DD是冠心病心肌梗死的独立风险因子。近年少数研究开始注意ACE基因I/D多态与DN等微血管病变的关系。已经证实ACE基因I/D多态变化可通过影响血管紧张素Ⅱ和血管舒张肽缓激肽而影响系统性和肾内的血管舒缩及血流动力学改变,这可能增加肾灌注压及GFR,从而促使肾病的发生。
②红细胞膜Na+/Li+逆转运(SLC)活性:红细胞膜上SLC活性增高是原发性高血压遗传易感性的标志。不少研究报道,DN患者红细胞膜上SLC活性明显高于不伴肾病的糖尿病患者Carr等报道IDDM患者于出现肾病以前即发现细胞膜SLC活性增高,还发现SLC活性增高者的肾小球滤过率明显升高而肾病早期表现为肾小球滤过率增高故红细胞SLC是早期检测NIDDM患者并发肾病的一个有用指标。
③N-乙酰转移酶(NAT2)基因:硫酸肝素蛋白多糖(HS-PG)系肾小球毛细血管基底膜、系膜及血管壁葡萄胺聚糖的主要成分,在维护其结构完整性上起重要作用。NAT2是HS-PG硫酸化的关键酶。NAT2有遗传多态现象,有的对高血糖的反应敏感,活性易受抑制,从而抑制HS-PG的合成,影响肾小球基膜的完整性,易出现蛋白尿另一些NAT2基因表达的NAT2不易受高血糖等因素的影响,因而不易出现蛋白尿有报道NAT2基因的点突变可引起乙酰化过程变慢与IDDM患者的微量白蛋白尿有关联。
④醛糖还原酶基因:高血糖导致多元醇活性通路上的第1个关键酶为醛糖还原酶(AR)。在相同高血糖条件下伴高AR活性的糖尿病患者对包括DN在内的慢性并发症易感。Hamado等报道糖尿病患者红细胞内AR活性变异很大。短期内发生糖尿病微血管并发症的糖尿病患者红细胞内AR活性明显高于病程>25年却不伴明显糖尿病并发症的患者。AR基因表达水平可部分地影响多元醇产物的生成速率故推测因AR基因异常而造成AR活性差异可能与DN等微血管病变的发生有一定联系。
⑤其他遗传因素:除以上一些遗传因素或基因以外,学者们尚对其他一些遗传因素进行了探索。Ronningen研究114例病程大于15年的IDDM患者的HLA-DR-DQ基因和胰岛素基因,并未发现微量白蛋白尿与HLAⅡ类抗原基因区有任何关联,亦未见到与胰岛素基因多态有关。个别研究报道了胶原(collagen)IVla基因HindⅢ酶切多态与NIDDM伴发肾病菌和视网膜并发症有一定关联Mimura在NIDDM中研究红细胞Na+/K+-ATPase活力与DN的关系
发现伴微量白蛋白尿组的红细胞Na+/K+-ATPase显著低于未合并微量白蛋白尿组。近年有人在5例糖尿病伴有肌萎缩、肾病或慢性肾衰患者中发现有线粒体基因5778bp的缺失,并认为这可能是因机体有关组织氧化磷酸化障碍所造成。
DN的遗传机制并未最后阐明学者们从各个角度以及从肾脏病变病理生理过程的各个可能环节进行研究,发现了一些遗传因素,因为糖尿病就其绝大多数而言是多基因、多因子疾病,故其肾脏病变的遗传问题亦可能是多基因多因素综合影响的结果。寻找出主要的影响基因发现遗传易感性并加以早期干预才能进一步改善糖尿病的预后。
(2)生化代谢紊乱:
①多元醇途径:近20年来大量的研究证明糖代谢的多元醇途径激活是糖尿病慢性并发症的重要发病机制之一醛糖还原酶(AR)和山梨醇脱氢酶组成多元醇的代谢途径,在此通路中,AR以NADPH作为辅酶,将葡萄糖还原为糖醇-山梨醇再经山梨醇脱氢酶作用将其氧化为果糖,此反应需要NAD+作为辅酶,。 AR是多元醇通路中的主要限速酶,AR广泛存在于多种组织和细胞(如肝脏、视网膜、晶体及肾上腺等)肾脏多种组织细胞如肾小球基膜、系膜细胞、上皮细胞及足细胞等亦拥有丰富的AR体内通过NADPH/NADP+比例和周围葡萄糖浓度调节,控制AR活性而影响山梨醇和果糖的产生速度。AR催化反应时需要NADPH提供氢,NADP+对AR活性有抑制作用,高血糖时,NADPH增高>NADP+,AR活性增加。正常情况下,血糖正常时,AR与己糖激酶竞争葡萄糖的代谢,因己糖激酶对葡萄糖的亲和力(Km=0.1mmol/L)远高于AR(Km=70mmol/L),AR活性抑制,山梨醇生成很少,葡萄糖主要经糖酵解通路代谢糖尿病高血糖时,己糖激酶趋于饱和,AR活性升高致山梨醇生成增多。糖尿病易损害组织(如晶体、神经、视网膜和肾脏等)的一个共同特点就是其细胞内葡萄糖水平不受胰岛素调控在高血糖时,这些组织细胞内葡萄糖浓度与血糖水平相平行,高血糖致AR活性增高多元醇代谢通路活化。
多元醇通路活化通过多种机制加速糖尿病慢性并发症的发生:①组织细胞内山梨醇浓度增加,山梨醇是一极性很强的化合物,不能自由进出细胞,于是造成它在细胞内堆积,一方面造成细胞渗透性水肿,另一方面破坏细胞结构和功能的完整性,肌醇摄取减少,丢失增加从而影响磷脂酰肌醇的代谢,肌醇二磷酸转变成三磷酸肌醇不足,致Na+/K+-ATPase活性下降,进一步加重细胞代谢和功能的损害,产生病变。②山梨醇途径活化,NADPH消耗增加体内还原型谷胱甘肽的生成亦需NADPH提供氢AR与谷胱甘肽还原酶竞争利用NADPH,一旦NADPH不能满足需要,还原型谷胱甘肽生成减少,细胞内氧化还原失平衡,机体抗氧化能力降低,自由基清除减少,损害组织和细胞功能;③细胞内增多的山梨醇在山梨醇脱氢酶作用下进一步还原为果糖组织蛋白果糖化增加危害其功能动物实验报道糖尿病动物肾组织ARmRNA表达增加,山梨醇含量明显高于对照组肌醇减少和Na+/K+-ATPase活性下降,而AR抑制药可预防和纠正上述变化。有作者应用AR抑制药――Sorbinil治STZ糖尿病大鼠可明显降低尿蛋白排泄,防止或减轻GBM增厚。目前多数学者认为多元醇通路活化在DN的发生发展中起着相当重要的作用,早期应用AR抑制药对糖尿病慢性并发症有一定的防治作用,一旦并发症已经发生,组织细胞常已发生不可逆损害,则效果不佳。国内有学者报道一些中药,如槲皮素及水飞蓟宾等亦可抑制AR。
②蛋白质非酶糖化:葡萄糖分子和蛋白质的非酶促糖化反应已被人们普遍认识,它在糖尿病多种慢性并发症的病因学方面起相当重要的作用。蛋白质非酶促糖化系糖类(主要为葡萄糖,其他尚有果糖半乳糖及丙糖等)、醛基与各种蛋白质N端游离氨基酸或赖氨酸残基的ε-氨基团间的亲核添加聚合过程,亦称添加反应或Maillard反应。葡萄糖分子先与蛋白质氨基酸形成不稳定的糖化产物(Schiff反应)其形成速率(K1)=离解速率(K-1),几小时就可达到平衡在早期,蛋白质非酶促糖化量随血糖升高及蛋白质和葡萄糖接触时间的延长而增加,血糖恢复正常时可逆转,但在持续高血糖情况下早期糖化产物进一步经过缓慢的化学结构重排(一般数周),形成一种比较稳定的糖-蛋白质产物,即Amadori产物(酮胺化合物),Amadori产物也是可逆平衡的,一般经过4周达平衡。所形成的Amadori产物大部分再经过脱水和分子重排,形成复杂和生理转损率低的大分子糖化终末产物(advanced glycation and products AGEs)而堆积在半衰期长的蛋白质(如胶原蛋白、晶体蛋白及弹性蛋白等)及血管壁上,并随着时间的延长而累积,此时即使有效地纠正高血糖,被糖化的蛋白质亦不能恢复正常。
蛋白质非酶促糖化导致蛋白质理化性质、功能及结构改变,通过多种途径促进糖尿病慢性并发症发生。①蛋白质调节功能改变:如血红蛋白糖化后,致其与23-二磷酸甘油结合力下降、氧离曲线左移、组织缺氧微血管扩张;抗凝血酶Ⅲ糖化后,其抗凝作用降低,致血液呈高凝状态,AR糖化后,其活性增加参与多元醇途径的活化;低密度脂蛋白(LDL)糖化后,与其受体的亲和力下降,LDL清除减少,致血浆中LDL浓度升高渗入血管壁,经巨噬细胞清道夫途径清除增加,形成泡沫细胞,促进血管并发症发生。②血管外半衰期长的不可溶性基质蛋白(如血管基质、肾小球基膜、神经髓鞘、晶体蛋白及皮肤胶原蛋白等)可通过AGEs相互交联,交联后的蛋白质对蛋白水解酶的降解作用抵抗,清除减少,这可能与血管壁增厚、弹性降低及GBM增厚有关;交联后基膜本身三维结构变形,分子间的交联度明显减少约40%,膜中裂孔增大,通透性增加,蛋白质滤出增加。此外,糖化的蛋白质与基膜中重要的阴离子蛋白聚糖成分硫酸乙酰肝素的亲和力降低清除增加,一方面损伤基膜的电荷屏障,同时丧失抑制基膜及系膜增生的作用而致基膜及系膜增生,最终血管腔闭塞和系膜区扩张。③糖化后的血管基质蛋白可通过AGEs捕获渗出血管外的可溶性血浆蛋白,如富含胆固醇的LDL捕获增加,致LDL在局部堆积,促进动脉硬化;捕获免疫球蛋白,如IgG和白蛋白等增加可引致毛细血管基膜进行性增厚和血管闭塞。④AGEs与特异性AGEs受体结合,引起细胞因子如白细胞介素-1(IL-1)和肿瘤坏死因子(TNF)释放增加,这些细胞因子进一步刺激附近间皮细胞合成和释放胶原酶及其他细胞外蛋白水解酶使AGE-蛋白质降解清除,但在长期高血糖状态下,AGEs在基质蛋白质上不断堆积,单核巨噬细胞、肾小球系膜细胞及内皮细胞膜上AGEs特异性受体不断与AGEs结合而释放大量的细胞因子如IL-1和TNF等,在局部引起一系列代谢变化如IL-1可使成纤维细胞、平滑肌细胞系膜细胞及内皮细胞增殖,增加肾小球胶原蛋白合成;TNF与胰岛素有协同促生长作用,并增加靶细胞对其他生长因子的反应性和刺激血小板释放血小板衍生的生长因子等。上述细胞因子尚可损伤内皮细胞及促进多阴离子蛋白多糖降解致血管壁通透性增加。⑤最后蛋白质非酶糖化尚可促进自由基产生增加,参与糖尿病氧化应激,此亦加速慢性并发症发生。
蛋白质非酶促糖化通过多种途径促进糖尿病慢性并发症发生发展因此良好的血糖控制或应用一些化合物阻断非酶促糖化过程则可逆转上述病理过程最近研究发现氨基胍为一无毒亲核肼类化合物,可竞争性抑制AGEs形成,同时亦进一步证实蛋白质非酶促糖化在DN发生发展中起重要作用
③脂质代谢紊乱:糖尿病患者除主要表现为糖代谢紊乱外常存在脂质代谢的异常,血胆固醇、TG、LDL及APOB升高HDL和APOA1水平降低或正常。伴DN时,上述变化更加明显。脂质代谢异常可损害肾脏,促进肾小球硬化发生发展。
血脂异常损伤肾脏促进肾小球硬化的可能机制一般认为如下:①肾小球脂质沉着,渗入肾小球的单核细胞和巨噬细胞吞噬脂质增加,变成泡沫细胞;②肾组织胆固醇及胆固醇酯含量绝对增加;③肾内脂肪酸结构改变(必需脂肪酸相对缺乏),致肾内缩血管活性物质释放增加,升高肾小球毛细血管内压;④高脂血症增加血浆黏度和红细胞刚性改变肾小球血液流变学;⑤最近有关富含胆固醇LDL,尤其是氧化修饰(Ox-LDL)和糖化LDL,在肾小球硬化中的作用受到很大重视。经氧化和糖化修饰的LDL其代谢途径发生改变,它似与APOB/APOE受体结合能降低,血浆中LDL清除降解随之减少,致LDL血浓度升高,结果经单核细胞和巨噬细胞等清道夫途径清除增加实验报道肾小球系膜细胞有LDL、Ox-LDL及糖化LDL受体表达,而且系膜细胞对Ox-LDL及糖化LDL的摄取强于LDL。LDL不仅刺激系膜细胞增殖,同时刺激系膜细胞产生胞外基质及单核细胞趋化因子,直接招致单核巨噬细胞浸润通过清道夫途径吞噬LDLOx-LDL及糖化LDL等后变成泡沫细胞并释放多种细胞因子和生长因子,如血小板衍生的生长因子CPDGF、IL-1及转化生长因子(TGF-β)等,促进系膜细胞进一步增殖和合成基质,参与肾小球硬化。糖尿病患者除LDL增高,常伴有Ox-LDL和糖化LDL水平增加。⑥此外,有报道血糖控制不佳或伴白蛋白尿的IDDM患者,血LP(α)常增高,LP(α)是一大分子糖蛋白,与纤维蛋白溶酶有相似的同源性能与纤维蛋白溶酶竞争结合纤维蛋白和纤维蛋白原从而抑制纤溶酶活性,导致凝血和血栓形成。糖尿病患者通过良好的血糖控制可明显改善脂质代谢异常或使其恢复正常。

(3)肾小球血流动力学改变:
①肾小球血流动力学改变对肾病发生发展的影响:糖尿病患者早期肾小球滤过率(GFR)显著升高,尤其是新诊断的IDDM患者其GFR可较正常人增高25%~40%;在新诊断的NIDDM患者中亦可见相似现象近年来大量的动物实验证实应用血管紧张素转换酶(ACE)抑制药,降低肾小球内高压,改善肾小球血流动力学可明显防止糖尿病肾小球硬化,有力提示了肾小球血流动力学改变对DN的发生发展具有重要作用甚至可能是DN的始发因素现一般认为持续肾小球高滤过,尤其是持续肾小球内高压,主要通过以下两方面对肾小球产生损害作用:①持续肾小球高滤过和肾小球内高压可损害肾小球毛细血管内皮细胞,致滤过膜通透性增加,血浆大分子物质渗出系膜区增加,而且糖尿病时系膜细胞清除大分子物质的能力降低,致系膜区阻塞。另外,大分子物质在系膜区积聚过多可刺激系膜细胞增殖,促进系膜基质产生增加以致系膜区扩大加速肾小球硬化②持续肾小球毛细血管内高压可刺激肾小球滤过膜上皮细胞胶原蛋白合成增加致GBM增厚,同时亦刺激系膜区系膜细胞基质产生增加,最终促进肾小球硬化,肾小球功能丧失,残存肾小球代偿性高滤过形成恶性循环,最后发生肾功能衰竭。
②肾小球高滤过的原因与机制:
A.高血糖:糖尿病代谢紊乱主要由于胰岛素绝对或相对缺乏所致的糖代谢紊乱,动物实验和临床研究均显示输注葡萄糖致高血糖可使GFR增高严格控制血糖可使高滤过的糖尿病动物及糖尿病患者GFR降低增大的肾脏恢复正常糖尿病高血糖除直接致红细胞内血红蛋白糖化增加、2,3-二磷酸葡萄糖产生减少、血红蛋白与氧的亲和力增强引起组织缺氧、肾血管扩张、RPF增加、GFR增高以外多数学者认为尚可能通过以下途径发挥作用。
a.肾素-血管紧张素系统(RAS)调节障碍:RAS包括肾素、血管紧张素原、血管紧张素-Ⅰ(Ang-Ⅰ)、血管紧张素-Ⅱ(Ang-Ⅱ)及ACE等5部分组成。循环中的肾素主要来源于肾内的肾素生成细胞,常以非活化的前肾素形式存在,约占90%以上经胰蛋白酶处理后形成活化肾素,可直接作用于血管紧张素原而使之转化为Ang-Ⅰ,Ang-Ⅰ再在ACE的作用下水解释放出一段8肽,即Ang-Ⅱ。Ang-Ⅱ具有强烈缩血管作用并具促细胞生长增殖的作用及刺激细胞生长因子(如内皮素表皮生长因子等)合成和分泌除了上述循环RAS之外,晚近通过分子生物学及免疫组织化学方法发现许多组织局部亦有RAS,并通过旁分泌和自分泌形式对分泌细胞自身和周围邻近的细胞发生作用,尤其是肾脏局部的RAS的作用更引人注意。RAS系统通过全身及局部的作用调节肾脏血流动力学及其他机制参与多种肾脏疾病的病理生理过程中国有作者报道糖尿病患者尿肾素及Ang-Ⅱ活性明显增高,其水平不依赖于循环中。肾素及Ang-Ⅱ水平,能更好地反映肾组织局部RAS;分子生物学研究证实糖尿病大鼠肾组织肾素、血管紧张素原m RNA表述增加提示糖尿病或高血糖时,肾内局部组织Ang-Ⅱ活性增强。Ang-Ⅱ通过分布于肾血管和系膜细胞等组织细胞上的特异性受体发挥作用:收缩肾小球入球和出球小动脉,尤其相对收缩肾小球出球小动脉,致PGC升高。此外,Ang-Ⅱ可进一步促进前列腺素合成,相对扩张肾小球入球小动脉,共同致肾小球高滤过和肾小球内高压;促进系膜细胞生长增殖及分泌基质增加,引致系膜区扩张;系膜细胞收缩,滤过膜通透性增加,促进蛋白尿发生。从80年代中期开始,大量的动物实验证实ACE抑制药通过抑制肾内Ang-Ⅱ活性可明显改善糖尿病动物早期肾小球血流动力学异常,尤其显著降低PGC,有效防止DN的发生和发展临床研究亦报道短期服用卡托普利(开搏通)可明显降低高滤过糖尿病患者的GFR和滤过分数,其作用不依赖于循环RAS的作用及系统性血压的降低,进一步提示RAS在介导糖尿病肾小球血流动力学中的作用。最近有研究报道糖尿病患者ACE基因多态性与DN发生有关,17号染色体上ACE基因位点DNA的顺序不同于IDDM患者,与DN先天易感性相关 。
b.激肽-前列腺素-血栓素系统调节障碍:激肽是一组具有生物活性作用的多肽,它们不是由某一特定的器官或内分泌腺体所产生和分泌,而是在血浆及一些组织中由激肽释放酶作用于激肽原,裂解后产生的一类活性多肽,往往在局部产生反应后即被相应的酶迅速灭活,在肾脏存在组织型激肽释放酶,作用于激肽原后生成10肽的胰激肽,再经氨基肽酶作用生成9肽的缓激肽,缓激肽与其特异性细胞膜受体结合,通过磷脂酶C和磷脂酶A2分别产生肌醇三磷酸(IP3)、二酰甘油(DGA)、花生四烯酸及前列腺素衍生物等发挥作用其对肾小球血流动力学的主要影响为:缓激肽作用于肾小球毛细血管内皮细胞,使后者释放内皮细胞舒张因子再作用于血管平滑肌,使其扩张;缓激肽通过与肾髓质间质细胞膜上的受体结合,活化磷脂A2通路生成前列腺素E2(PGE2),后者扩散到邻近血管壁,发挥血管舒张作用,致RPF增加和GFR升高。有临床研究报道糖尿病早期体内缓激肽水平升高,提示激肽可能参与了糖尿病早期肾小球高滤过的形成。此外,激肽尚与RAS有密切的关系,注射激肽可促进肾素的释放;另一方面Ang-Ⅱ亦能刺激组织释放激肽释放酶,促使激肽生成,共同维持血管张力的平衡。
已知整个肾小球和系膜细胞均具有合成前列腺素(PG)和血栓素(TX)的能力。动物实验证实STZ糖尿病动物早期PGE2和PGF2α的产生较正常对照组增高2~3倍,并发现PG产生增加与血糖水平有一定关系。此外血管收缩剂TXA2的产生亦增加,早期以扩血管性PG产生显著增加为主,但不持久而TXA2的合成增加是持续的,肾小球TXA2合成增加伴随尿TXB2(TXA2的稳定代谢产物)排泄增加与尿蛋白的发生发展相关。不少临床研究亦报道糖尿病患者尿6-酮-PGF12(PGI2稳定的代谢中间产物)、PCE2和TXB2排泄显著增加。PGI2和PGE2可明显降低肾血管阻力,尤其是肾小球入球小动脉阻力,致RPF增加,同时TXA2相对收缩肾小球出球小动脉,致PGC升高,两者相互作用协同参与肾小球高滤过的形成。STZ糖尿病大鼠早期应用环氧化酶抑制药如吲哚美辛和阿司匹林可明显防止肾小球高滤过,对预防DN的发生有一定作用。最近有临床研究报道应用抗血小板药物――Triful选择性抑制TXA2合成,明显降低尿TXB2排泄相对扩张肾小球出球小动脉降低PGC,可明显降低早期DN患者尿白蛋白的排泄。
c.心钠素(ANP)释放增加:ANP是哺乳动物心房肌细胞分泌的具有强大利钠、利尿和扩血管活性的肽类激素,主要在血管内容积增加所致的局部牵张刺激下由心房肌细胞分泌出来在肾脏,ANP与肾内微血管床上特异性高亲和力受体结合,显著降低肾血管阻力,尤其是入球小动脉扩张,RPF增加和PGC增加,使GFP明显增加此外,ANP还能舒张肾小球系膜细胞,使滤过面积增加动物实验还发现对离体的肾小球灌注ANP可使肾小球毛细血管超滤系数增加。Oxtola等认为,糖尿病长期高血糖致慢性血容量扩张,刺激ANP释放增加动物实验证实糖尿病大鼠早期血浆ANP浓度明显升高,用胰岛素使血糖下降可防止ANP增高Perrico等进一步采用ANP特异性抗血清阻断内源性ANP的作用,可降低高血糖尿病大鼠GFR提示ANP对介导糖尿病早期肾小球高滤过起一定作用。
B.蛋白质摄入增加:早在40年代就提出限制慢性肾功能不全病人的蛋白质摄入可防止或降低残存肾单位的过度负荷减慢肾功能恶化速度。动物实验表明高蛋白饲养(蛋白质占总热卡40%)可加重大部分肾切除非糖尿病大鼠残肾代偿性高滤过,加速肾小球硬化,低蛋白饲养(占总热卡6%)可使残肾GFR降低,对肾小球损害有保护作用;在糖尿病动物中亦证实,在相似高血糖状态下,高蛋白饲养(占总热能40%~50%)可使已存在的肾小球高血压和高滤过进一步加剧,加速DN发生发展(GBM增厚和系膜区扩张);临床研究亦报道给健康人蛋白餐或输注氨基酸后,GFR上升30%~40%;对伴高滤过的早期IDDM患者短期适当限制蛋白质(45g/d)摄入GFR明显下降;最近有作者研究发现不同种类蛋白质对肾小球血流动力学影响不一,含相对较少甘氨酸、丙氨酸和精氨酸(已知这3种氨基酸易致肾小球高滤过)的蛋白质如禽蛋等,对肾小球血流动力学影响小蛋白质摄入GFR上升主要由肾血管扩张.,尤其是入球小动脉扩张,RPF增加和PGC增高所致。这种扩血管可能由肾脏局部合成扩血管性PG增加,或依赖于胰高血糖素分泌增加或球管平衡改变所致。
C.其他:糖尿病患者,尤其是IDDM患者常伴血胰高血糖素、生长激素及胰岛素样生长因子等浓度升高,亦可能与肾小球高滤过部分有关;来自血管内皮细胞的松弛因子(ND)亦具有很强的扩血管作用;酮体的输注亦能升高GFR,但它对糖尿病患者肾小球高滤过的作用不肯定,因无酮症者亦存在肾小球高滤过
(4)高血压的影响:
糖尿病患者中高血压明显加速DN的发生和进展,DN的发生进一步升高血压形成恶性循环。临床流行病学研究发现有高血压的糖尿病患者肾脏病变的发生率及发展速度远较无高血压者为快国外亦有作者报道在糖尿病病程和血糖控制程度相似的情况,伴高血压与不伴高血压的患者相比,微量及大量白蛋白尿的发生显著升高。尤其在病程>20年的患者中,伴高血压者微量及大量白蛋白尿发生率分别为16.7%和83.3%而不伴高血压者仅为35.7%和7.9%
高血压促进DN发生发展主要与其影响肾小球血流动力学有关。正常情况下,在一些类似原发性高血压的动物模型中观察到,尽管动脉血压很高而因肾小球入球小动脉阻力和出球小动脉阻力相应增加,尤其是入球小动脉阻力增加大于出球小动脉,并无RPF增加和PGC增高现象。这种增高的入球小动脉阻力保护了肾小球毛细血管不受全身高血压的损害。但随着高血压时间的延长及高血压程度的加剧,增高的入球小动脉阻力不再能克服过高的血压,加上动脉硬化的形成,小动脉弹性纤维的损伤,尤其在糖尿病或血糖控制不佳的情况下肾血管自身调节障碍肾血管阻力下降,肾小球入球小动脉相对扩张,结果系统性高血压传递至肾小球囊内,形成肾小球内高压,加速肾小球硬化。最近有不少作者研究发现伴红细胞膜Na+/Li+逆转移活性(原发性高血压的遗传标志之一)增高的糖尿病患者易呈肾小球高滤过,进一步研究还发现伴红细胞Na+/Li+逆转移活性增高的糖尿病患者其肾小球入球小动脉对Ang-Ⅱ的缩血管反应缺陷,结果入球小动脉扩张、RPF增加和WGC增高致肾小球高滤过,呈现对DN易感。上述资料提示糖尿病伴高血压,有时即使血压不高或仅有原发性高血压遗传倾向的患者,亦可能存在肾小球内高压。临床上ACE抑制药可降低早期糖尿病患者肾小球高滤过和滤过分数减少早期DN患者尿白蛋白排泄延缓临床DN患者GFR下降速度,其作用除有效降低血压外,主要可能通过抑制肾内Ang-Ⅱ生成和降低肾小球内高压有关。
(5)其他因素:
(1)氧化应激:糖尿病情况下常伴以主要由葡萄糖及糖化蛋白的自动氧化所致的体内自由基产生明显增加,机体抗氧化能力降低(如细胞NADPH含量不足,血浆抗氧化剂如维生素C、维生素E、辅酶Q10及硒水平降低超氧化歧化酶活性降低),致机体存在明显的氧化应激。自由基是具有不配对电子的原子、原子团或分子,在人体内过度聚集对多种组织如蛋白质脂质及核酸均具有损害作用,参与糖尿病并发症的发生。红细胞膜脂质过氧化可降低其膜的流动性增加其对内皮细胞的黏附性自由基可攻击体内不饱和脂肪酸,产生脂质过氧化物和丙二醛,丙二醛具有很强的交联性,能与含游离氨基酸的蛋白质发生交联形成Schiff碱,可致血管基膜增厚。自由基尚可使结缔组织中透明质酸降低,失去黏性,破坏细胞间的填充黏合质使微血管通透性增高 LDL过氧化,改变其代谢途径,亦参与大小血管的硬化。Kashiharo等报道肾小球系膜细胞的氧化应激可选择性降低其硫酸肝素蛋白多糖的合成,损害肾小球滤过膜电荷或结构屏障。
(2)细胞生长因子:细胞生长因子在DN发生机制各中间环节的作用最近受到较大重视目前已知肾小球实质细胞,尤其是系膜细胞,可表达、合成和分泌多种细胞因子,如IL-1,6,8、TGF-β、TNF等。这些细胞因子通过旁分泌和自分泌发挥其病理生理作用。
①白细胞介素(IL):细胞培养研究表明肾小球系膜细胞和上皮细胞能以旁分泌的方式产生细胞因子IL-1、IL-6及IL-8等同时又能以自分泌的形式作用于肾小球系膜细胞本身,从而诱导肾小球系膜细胞产生一系列生化和生理功能反应,导致肾小球细胞外基质增加及基膜降解、破坏。动物实验显示糖尿病大鼠系膜细胞表达IL-1mRNA增强,IL-1合成分泌增多,引起细胞外基质增多,最终参与了DN的发生。近年研究证实人类和大鼠的系膜细胞均可表达IL-6mRNA和分泌IL-6并可刺激系膜细胞增生,导致细胞外基质合成增加是一种较IL-1和PDGF更强的肾小球系膜细胞增殖诱导剂。
②转化生长因子-β(TGF-β):肾小球多种实质细胞,尤其是系膜细胞,可丰富地表达TGF-βmRNA,合成和分泌TGF-β,并拥有TGF-β特异性受体。TGF-β通过以下途径调节肾小球细胞外间质的合成和降解等:①刺激细胞外间质成分的产生,已证实TGF-β几乎增加系膜细胞所有细胞外基质成分如胶原蛋白Ⅰ、Ⅲ、Ⅳ纤维连接蛋白、层粘连蛋白(laminin)、蛋白多糖及decorin等mRNA表达、合成和分泌;对肾小球上皮细胞,TGF-β亦可使纤维连接蛋白、蛋白多糖、decorin及胶原蛋白合成增加。②抑制细胞外降解酶的合成和活性:TGF-β可抑制组织细胞蛋白水解酶mRNA的表达、合成和分泌,使细胞外基质降解减少,同时TGF-β尚刺激某些蛋白水解酶抑制药的产生,有效地使蛋白水解酶活性降低结果致细胞外间质成分稳定升高,促进肾小球硬化。有作者指出TGF-β可能是糖尿病肾小球硬化的一个生长介导因子动物实验应用TGF-β阻断剂可部分防治肾小球硬化。
③肿瘤坏死因子(TNF):TNF对系膜细胞的影响是多方面的,TNF可增加系膜细胞IL-6、IL-8mRNA的转录,刺激系膜细胞增殖,增加合成和分泌PC及细胞外基质(胶原蛋白、层粘连蛋白、纤维连接蛋白及蛋白多糖等)。另外,TNF尚可诱导血管内皮细胞纤维酶原激活物抑制药的表达和合成,导致肾小球内血栓形成及纤维素样坏死,激活系膜细胞超氧阴离子和过氧化氢的形成糖尿病情况下,肾小球TNF产生增加,促使肾脏受损严格控制血糖或应用氨基胍抑制AGEs形成,可明显降低STZ糖尿病大鼠TNF和IL-1的产生。
④血小板衍生的生长因子(PDGF):PDGF是一种主要来源于血小板、对多种细胞具有生长促进作用的肽类细胞活性因子。肾小球系膜细胞亦能分泌PDGF,并拥有PDGF受体同时受PDGF调节。Aboud等认为PDGF是多肽类生长因子中对系膜细胞促有丝分裂作用最强的一种已证实PDGF可直接作用于系膜细胞,刺激其DNA合成和分裂增殖,增加细胞外基质合成。在代偿性肾肥大及DN的发生机制中,PDGF作为强有力的促有丝分裂原,是系膜增殖的启动信号。糖尿病时,系膜细胞产生的PDGF和PDGF受体的表达增强,维持着系膜细胞的持续增生,表现为肾小球系膜增生肾小球肥大。
⑤胰岛素样生因子(IGF):IGF包括IGF-Ⅰ和IGF-Ⅱ,结构均与胰岛素相似。研究表明肾脏组织也是合成IGF的重要部位体外研究显示系膜细胞膜上有IGF-Ⅰ受体并可持续合成和分泌IGF-Ⅰ。动物实验给大鼠直接IGF-Ⅰ可降低肾血管阻力,明显增加RPF和GFR;IGF-Ⅰ注入大鼠体内可使肾脏体积明显增大;IGF-Ⅰ高可刺激系膜细胞合成Ⅳ胶原。另外,IGF-Ⅰ尚可使Ang-Ⅱ与系膜细胞上受体结合增强,细胞内钙含量明显上升,亦促进系膜细胞增殖和细胞外基质分泌增多。因而参与了糖尿病早期肾小球高滤过和肾小球肥大的发生。
⑥内皮缩血管肽(endothelin,ET):ET是一种具有强烈缩血管作用和促细胞生长增殖的多肽,循环中的ET主要由血管内皮细胞合成和分泌。近年来许多研究证实肾脏多种组织亦丰富地表达ETmRNA,合成和分泌ET,尤其是ET-1,同时拥有ET受体,与多种肾脏疾病,包括DN发生发展有关。ET通过多种途径发挥病理生理作用:
A.ET可致肾小球毛细血管收缩,尤其是出球小动脉收缩明显,升高肾小球内压力,另外,ET可活化系膜细胞磷脂酶A2,促进TXA2形成增加亦致肾小球内压力升高。
B.ET可强烈刺激系膜细胞由静止期进入G2期,促进系膜细胞DNA合成和有丝分裂而产生生长增殖作用,刺激系膜细胞合成Ⅰ、Ⅲ、Ⅳ型胶原及层粘连蛋白增加肾小球上皮细胞合成蛋白多糖等最后致GBM增厚及系膜区扩张;③ET尚可刺激系膜细胞合成和释放TNF、PDGF等以及肾髓质产生超氧阴离子和过氧化氢增加等Fukui等报道理想的血糖控制,ACE抑制药及Ang-Ⅱ受体拮抗药等可降低糖尿病大鼠肾小球组织ET-1mRNA水平,应用ET抗体、ET受体抗体等可明显减轻肾小球损伤或防止肾功能恶化。
总之,糖尿病肾组织多种细胞因子表达增强,合成和分泌增加,上述细胞因子从各个不同的环节引致系膜细胞生长增殖细胞外基质增加,致GBM增厚和系膜区扩张,促进DN发生。
(3)吸烟:已知吸烟是大血管动脉粥样硬化的危险因素之一一些临床研究报道,不论NIDDM或IDDM患者吸烟者与非吸烟者比较,糖尿病肾病发生率明显增高。Sawichi等报道吸烟不仅增加DN的发生,且加速DN肾功能的恶化并提出吸烟是血压控制良好的IDDM患者早期DN和临床DN进展的重要危险因素。
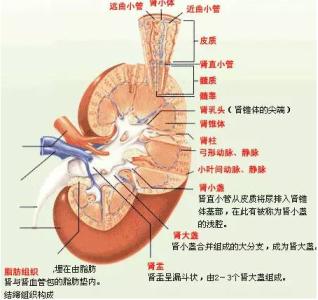
2.病理
(1)光镜下改变:糖尿病肾小球硬化症有3种组织病理学类型。
①弥漫性肾小球硬化症:表现为肾小球毛细血管基膜弥漫性增厚和肾小球系膜区弥漫性增宽。后者指肾小球毛细血管袢之间有逐渐增多的PAS染色阳性的均质蛋白性物质沉积因此,系膜区的增宽主要是无细胞性基质成分的增加,仅少数病例同时伴有系膜细胞的增生。若基膜和系膜区的病变同时或先后出现,即为弥漫性肾小球硬化症。
②结节性肾小球硬化症:由于肾小球系膜蛋白性物质的沉积,在肾小球小叶内形成一些球形结节,称Kimmelstiel-Wilson结节。结节大小为20~100μm,境界清晰,伊红色,均质性,PAS染色阳性。PASM(六胺银)染色球形结节内可见同心圆性层状结构。系膜细胞核常分布于结节周围,呈环状排列。结节性病变呈灶性分布,有的肾小球仅1个结节,有的可见数个,而有的肾小球则无结节。结节对周围毛细血管丛可产生压迫。早期肾小球毛细血管可呈血管瘤样扩张晚期随着结节的玻璃样变性和肾小球内渗出性病变的加重肾小球毛细血管丛逐渐闭塞,肾小球随之硬化。Kimmelstiel-Wilson结节是诊断DN的可靠指征,有形态学特异性。尤其是当肾小囊尚未粘连结节周围的肾小球毛细血管丛尚未闭塞时,结节的出现对诊断DN有很大价值然而并非所有糖尿病性肾小球硬化症都会出现特征性结节性硬化。但弥漫性硬化改变总是存在的。因此有人认为弥漫性和结节性肾小球硬化症可能是同类病变的不同发展阶段,弥漫性病变在前,结节性硬化在后。
③渗出性肾小球硬化:在弥漫性或结节性肾小球硬化的基础上,球囊腔内可有成团伊红色纤维素样物质沉积,这些物质纤维素染色和PAS染色阳性,含有蛋白质、多糖和脂质显然是血浆成分的渗出,病变并无特异性。这些物质如沉积于肾小囊基膜和壁层上皮之间,称为肾小囊滴状病变(capsular drop);如沉积于肾小球毛细血管丛周缘部分的内皮细胞下,则称为纤维素样帽状沉积(fibrin cap)。这2种病变常与肾小球硬化症合并存在并往往在病情进展尿蛋白急剧增加的情况下出现。
在肾小球发生硬化的同时,肾小管基膜亦呈弥漫性增厚。如患者高血糖未能控制,血浆和原尿中的葡萄糖可进入肾曲小管上皮,造成肾小管上皮细胞内糖原沉积在常规切片制片过程中,糖原溶解使肾小管上皮细胞呈空泡变性,称为糖原性肾病(glycogen nephrosis),或AE病变(Armanni-Ebstein lesion)。随着肾小球硬化性病变的形成,相应的肾小管也逐渐萎缩,间质纤维组织增生并有慢性炎性细胞浸润。
(2)电镜下改变:在电镜下糖尿病性肾脏改变最早期的病变是肾小球毛细血管基膜弥漫性增厚,其厚度可比正常增加1.5~5倍。增厚的基膜在电镜下呈纤维状撕裂。肾小球毛细血管基膜的病变实际上是全身性糖尿病性微血管病变的一部分有5年以上糖尿病病史的人,90%均可在电镜下观察到这一改变。甚至在临床出现糖尿病症状之前,有一部分病人就可以有基膜的弥漫性增厚这往往比肾小球系膜区基质的增生发生得早。如果电镜下毛细血管基膜弥漫性增厚和系膜区基质弥漫性增生同时存在即为弥漫性肾小球硬化症。
在结节性肾小球硬化症系膜内结节电镜下呈索条状结构并可见脂质空泡和细胞碎片镶嵌其中。肾小囊滴状病变和毛细血管袢的帽状沉积电镜下为颗粒状电子致密物,并混杂有脂类物质和基膜碎片。
(3)免疫荧光和免疫组织化学改变:利用免疫荧光或免疫组织化学方法可显示IgG沿肾小球毛细血管壁、肾小管基膜及肾小囊基膜呈线性沉积,这是糖尿病肾小球硬化症的特征性改变同时强度较弱的IgA、纤维蛋白也可呈线状沉积,C3可呈弱阳性沉积于系膜区。肾小囊滴状病变及毛细血管的帽状沉积中常有大量IgM沉积。这种免疫病理改变可能是由于血浆蛋白附着于变性毛细血管基膜所致的非特异性沉积。
糖尿病肾小球硬化症的正确诊断有赖于临床、光镜电镜和免疫病理检查结果的综合判断。许多其他疾病如肝病性肾小球硬化、膜增生性肾小球肾炎淀粉样变之肾脏改变以及多发性骨髓瘤所致的肾小球硬化均可出现与糖尿病肾小球硬化相类似的形态学改变,但是结节性肾小球硬化是DN较特异的诊断依据。
老人糖尿病_老年人糖尿病肾病 -临床表现
老年糖尿病肾病症状表现:神经病性恶病质是老年人糖尿病常见的一种特殊并发症,表现为抑郁、体重明显下降、周围神经病变伴剧痛,可在持续1~2年后自然缓解。足部皮肤大疱为糖尿病的较特有表现,皮肤大疱类似于Ⅱ度烫伤水疱,常在1周内逐渐消失,但可反复发作。尿潴留因出现尿频、尿痛、尿少伴下腹涨痛。视力模糊,糖尿病患者易出现视网膜病变,另外血糖尿糖升高也会影响视力。
老年糖尿病肾病症状表现还有肩关节疼痛,一些老年糖尿病患者可有肩周关节疼痛伴中、重度关节活动受限。有时顽固的肩周关节疼痛和关节活动受限成为老年糖尿病患者的唯一临床表现。精神心理异常表现为精神萎靡、抑郁、焦虑、悲观和记忆力减退,有些患者的精神心理异常与脑血管病变所致的脑萎缩有关。肌病包括不对称的肌无力、疼痛和骨盆肌、下腹肌萎缩。
DN临床表现变化极大,早期甚至毫无临床症状,晚期可出现终末期肾病的严重代谢紊乱和全身多系统受累其临床表现主要取决于患者所处的DN病分期及肾功能减退的程度。
目前将DN分为5期:
Ⅰ期:以肾小球高滤过和肾脏轻度增大为特征。表现为GFR升高肾小球毛细血管襻血浆流量增加和毛细血管内压增高等血流动力学变化。GFR升高25%~40%,可达150ml/min肾脏体积增加25%左右,但无明显的组织病理学上的改变,亦无任何临床症状目前一般的临床诊断方法无法发现,为糖尿病初期。
Ⅱ期:休息无尿蛋白排量增多。运动激发后可出现尿蛋白排量增高。该期肾小球开始出现结构性损害,但系可逆性。在此期GFR可能更高,可超过150ml/min部分患者血压开始从原有基础升高。在此期如能进行早期干预治疗,肾小球结构和功能可恢复正常。
Ⅲ期:表现为持续性尿白蛋白排量(UAE)增高(20~200μg/min),为高度选择性蛋白尿称为早期肾病也即通常所指的早期DN。在该期GFR逐渐恢复至大致正常水平,血压可略增高,但未达高血压水平。
早期DN中GFR与血浆流量的增加与血糖控制状态有一定关系,血糖控制后两者可下降。有人发现给予高蛋白饮食,GFR可增高,但限制蛋白质饮食后GFR可降低。
Ⅳ期:即临床肾病期。在尿微量白蛋白等早期诊断指标应用前临床上诊断的DN多为此期。该期特点为出现进行性增加的临床非选择性蛋白尿,GFR逐步下降。组织病理学改变逐步发展为肾小球硬化。
患者持续性或经常出现明显蛋白尿从UAE超过200μg/min(或300μg/24h)至大量蛋白尿的肾病综合征表现,临床表现变化幅度大此期内除早期蛋白尿可能有些选择性以外,主要为非选择性蛋白尿。糖尿病患者从糖尿病发病到出现蛋白尿,尿蛋白增加5~20倍以上。
DN的蛋白尿常与其他糖尿病慢性并发症如视网膜病变、大血管病变等并存,尤其蛋白尿(即使是持续性微量白蛋白尿)是冠心病、视网膜病变的风险因子,有预测意义。在进展性糖尿病肾病中,视网膜病变往往严重,与蛋白尿程度呈平行关系但有视网膜病变甚至因视网膜病变而失明的患者可以无蛋白尿。有人认为没有视网膜病变时不可能存在糖尿病性肾病,如果肾功能衰竭患者经过散瞳仔细检查未发现糖尿病性视网膜病变,则应考虑其他原因。蛋白尿的出现和程度有提示预后意义,蛋白尿超过3g/d是预后不良的征兆,如出现多量非选择性蛋白尿,预示数年内将进入肾功能衰竭期。
临床肾病期的患者常出现水肿,多见于两下肢轻度水肿。少数出现全身高度水肿往往提示有肾病综合征可能。产生水肿的原因并不相同多数轻度水肿者原因不明,可能与糖尿病性神经病变血管舒缩功能障碍有关,明显水肿往往与长期大量蛋白尿引起血浆白蛋白降低有关临床肾病后期可伴有肾功能不全、氮质潴留,引起排水障碍加重水肿,此时已是向Ⅴ期(肾功能衰竭期)移行阶段。
肾病综合征是DN临床肾病期的一种特殊临床类型,与儿童或成人慢性肾小球肾炎中的微小病变在临床表现为肾病综合征的不一样,糖尿病患者出现肾病综合征表现往往是临床肾病后期,预示肾功能衰竭即将来临。
随着尿蛋白的持续排出多数患者血压逐渐升高,但严重高血压不多见。原有高血压患者可加重,反之,高血压如不积极加以控制,可以进一步加重肾脏损害故积极有效地控制高血压十分重要。
Ⅴ期:尿毒症期。糖尿病临床蛋白尿期进一步发展,则肾功能逐渐减退直至进入终末期即尿毒症期。此时,肾糖阈常常明显增高而尿糖增多不明显,肾脏毁损时临床表现变化多样有多系统累及,各系统病变的严重可以不同 DN的终末期临床表现与其他肾脏病所致的尿毒症相似,分别描述如下:
1.水代谢障碍:随着DN进展,肾功能进一步毁损,浓缩及稀释功能更见减退尿比重固定在1.010~1.012,渗透压在280mOsm/kg左右与血浆相似,称为等张尿患者对水调节能力已明显减退,若胃纳不佳,摄水减少,酸中毒使呼吸幅度增大,呼吸道中丧失水分增多,再伴有腹泻、呕吐等,则易出现失水,肾小球滤过率极度下降,尿量日趋减少,血尿素氮、肌酐迅速上升。
2.电解质代谢紊乱:DN所致的尿毒症中电解质紊乱很常见,可以和脱水、水肿一起出现,可以单一亦可数种电解质代谢紊乱同时出现。
(1)钠代谢障碍:尿毒症时血钠浓度多属正常大多仍能保持摄入与排出的平衡。但若肾小球滤过率<25ml/min时,则调节的敏感度下降,需要较长时间方能使血钠水平趋于正常。此时可出现明显的钠平衡障碍发生失钠或钠潴留。由于患者水的排泄能力下降较钠排泄障碍出现为早,因此较易出现稀释性低钠血症。患者要出现许多神经系统症状,如表情淡漠、反应迟钝动作乏力肌肉痉挛抽搐等,严重时可出现昏迷。
(2)钾代谢障碍:正常时人体钾盐除经粪便及汗腺排出少量外,其余几乎全部由肾脏排泄。肾小球滤过液中的钾盐在正常情况下几乎全部由近曲小管以及髓襻所重吸收,而尿中排出的钾则主要为远曲小管所分泌若体内钾盐自组织中大量释出(如感染、创伤、消化道出血所致)则存在肾功能衰竭、肾血流量大幅度下降,由于排泄能力的下降,血钾可明显上升,呈现高钾血症。临床上可出现乏力肌力减退、腱反射减弱或消失。出现窦性停搏、房屋传导阻滞等心律失常,甚至心跳骤停。 DN以肾小球硬化为特点,肾小球损害为主。终末期以高钾血症多见。部分病例若进食不足,长期使用利尿剂或伴有腹泻时,亦可出现血钾过低。患者可出现倦怠无力腱反射减弱或消失,伴腹胀、肠鸣音降低,心率增快但心音钝并有室性期前收缩或阵发性心动过速,甚至心室扑动或颤动以致产生阿-斯综合征。
(3)钙、磷、镁代谢障碍:血钙在DN尿毒症时大多数均下降,其中以蛋白结合钙的减少较为明显血磷水平常上升,但由于甲状旁腺素的调节,使血磷浓度仍能维持下常,高磷饮食常使血磷剧增。尿毒症低钙性手足搐搦症发作者并不多,血浆中镁离子浓度和搐搦有关。血镁浓度在慢性肾功能衰竭中变化不大,少数病人偏高。肾脏排泄镁能力较强,但当肾功能严重损害时,镁排出终于受限,产生对中枢神经功能的抑制和神经、肌肉接头传递障碍而致反射减弱并可有肌力减弱、吞咽困难、嗜睡、房室或心室内传导阻滞,甚至出现呼吸中枢麻痹昏迷或心脏停搏等症状。
3.酸中毒:肾功能衰竭时体内积聚的酸性代谢产物主要为硫酸盐、磷酸盐类。硫酸盐主要自肾小球流出,肾小管很少重吸收,而磷酸盐则同时受肾小球滤过、肾小管重吸收的影响。当肾小球滤过率下降到20%左右时,几乎每个病例均有不同程度酸中毒,临床可表现为呼吸加深、胃纳减退、疲乏无力、心肌收缩无力及血压下降等。由于肾小管对氢离子排泄发生障碍,氢泵(自肾小管细胞内分泌氢离子入管腔)数目减少,氢离子在体内潴留,消耗了大量碱储,同时肾小管细胞生成氨(NH3)的能力下降而导致酸中毒。此时如糖代谢仍严重失控,脂肪代谢障碍,血中酮体水平增高,酸中毒较之其他原因所致的尿毒症酸中毒更重、更复杂。
4.蛋白质、糖、脂肪代谢障碍:DN尿毒症时血浆总蛋白值常较正常为低。慢性营养不良、出血、尿中蛋白漏失以及人体内代谢紊乱导致蛋白合成转化等功能障碍都是原因尿毒症时有明显糖代谢异常,但一般患者无糖尿病症状。肾功能衰竭时肾脏利用及灭活胰岛素能力下降病人对胰岛素需要量相对减少,若肾病患者中出现低血糖症状,要警惕是否已进入尿毒症期。尿毒症患者引起高甘油血酯血症的原因不完全明了,似乎是血三酰甘油移除速度缓慢,与心血管并发症发生率有关在低密度脂蛋白升高的同时常有高密度脂蛋白下降。
5.内分泌功能紊乱:DN慢性肾功能衰竭时可以出现各种内分泌激素代谢异常。这些障碍可概括为:①合成或分泌的紊乱:主要为肾素血管紧张素、泌乳素分泌过多,促甲状腺素、睾丸素等则分泌减少,活性维生素D合成亦明显减少;②激素的生物学作用障碍:以组织对胰岛素、睾丸对黄体激素反应降低较明显;③血浆蛋白结合异常:以甲状腺素结合球蛋白含量下降而致T4含量下降最主要血睾丸素水平下降可能也与蛋白结合的减少有关;④代谢障碍:许多激素通过肾脏的降解都受影响,因此其半衰期延长造成在血中蓄积。
6.各系统障碍表现
(1)消化系统:食欲不振常最先出现但程度各人不一。伴恶心,腹中饱闷口淡无味,口中有特殊的金属味。随病情加重出现呕吐,有时因滴水不进而产生失水。口腔黏膜肿胀溃疡,齿龈肿胀,舌大多干燥并可闻到尿味。胃及肠道溃疡的发生率可高达18%~24%可产生少量呕血或黑粪。少数病人可有便秘或腹泻。胰腺炎发生率甚高,据报道可达8%~19%。
(2)神经精神系统:神经精神症状在尿毒症中甚为普遍,尿毒症毒素的潴留、水及电解质失衡、酸碱失衡以及药物应用和高血压脑病等多有关系。透析治疗后发生失衡综合征更增加了神经系统症状的复杂性。中枢神经系统病变可有乏力记忆力减退注意力不集中、抑郁或时有急躁,少数病例表现兴奋多语、谵妄,亦可有视、听方面各种幻觉。晚期病例有嗜睡、表情淡漠,逐渐进入昏迷周围神经变在慢性肾功能不全中甚为多见累及感觉神经及运动神经,大多为对称性多神经炎患者常有麻木、烧灼、蚁行感等。尿毒症肌病表现为肌无力、肌肉颤动或肌萎缩等。
(3)造血系统:贫血为DN慢性肾功能衰竭最常见症状之一。由于肾单位严重损害,促红细胞生成素产生减少而产生严重的肾性贫血。骨髓受某些毒性产物的抑制,干扰了幼红细胞的增殖、成熟;毒物及代谢紊乱干扰干细胞生长的微环境,使红细胞生成素的作用减弱而导致贫血。由于Na+/K+-ATPase作用被尿毒症毒素抑制使红细胞内钠盐增加,影响红细胞脆性而易溶血。出血倾向在尿毒症患者常见,以皮肤黏膜为主表现为皮下瘀斑、齿龈结合膜下出血等,消化道出血、咯血、便血、鼻出血时有发生引起出血原因较复杂,血管壁受代谢障碍和营养不良等影响而致结构脆弱;血小板功能异常、血小板黏附功能降低也是原因之一。
(4)心血管系统;心血管系统病变为DN尿毒症患者死亡的重要原因之一。高血压十分常见,且与肾功能损害的程度有一定关系。尿毒症心肌损害称为尿毒症性心肌症。尿毒症者有心脏损害多见为:心脏肥大心律失常、心力衰竭、心肌梗死等。尿毒症终末期时可产生纤维素性心包炎。
(5)呼吸系统:DN尿毒症者由于免疫功能降低,易罹患感染,支气管炎、支气管肺炎较多见。也可有尿毒症间质肺炎胸膜炎。
(6)皮肤与黏膜表现:肤色常弥漫性变深,并伴黑色素沉着。皮肤干燥粗糙及瘙痒,皮肤易化脓性感染。
(7)免疫功能异常:DN尿毒症者有不同程度的免疫功能障碍易患多种感染并发乙型肝炎者甚多。周围血液中淋巴细胞数目减少血免疫球蛋白浓度也常偏低,中性粒细胞吞噬作用较差,移动灭菌能力测定亦均下降,胸腺常萎缩。
(8)水代谢障碍:DN肾功能衰竭病人排出多余水分所需时间比正常人为长,随着肾小球滤过率下降,尿浓缩能力下降,出现多尿及排尿节律改变,夜尿多。当出现少尿、水滞留时,水肿加重而发生水中毒及心力衰竭。
(9)电解质代谢紊乱:DN慢性肾功能衰竭晚期易出现稀释性低钠血症,钠平衡调节紊乱。由于调节钾代谢能力减退,可出现低钾血症或高钾血症;钙、磷、镁代谢障碍,常出现低钙高磷或高镁血症。
(10)酸中毒:肾脏为固定酸排泄的主要场所。在DN肾功能衰竭时体内积聚的主要是硫酸盐和磷酸盐类,它们主要自肾小球滤出,肾小管很少重吸收因此当滤过率下降到20%左右,则几乎每一病例均有不同程度的酸中毒。
(11)蛋白质、糖脂肪代谢障碍:DN慢性肾功能衰竭时血浆总蛋白值较正常为低,血中各种必需及非必需氨基酸水平亦较正常为低。尿毒症患者血中还原物质如尿酸肌酐葡萄糖醛酸大量积聚致使葡萄糖耐量异常。尿毒症患者常有血TG过高,患者血TG移除速度缓慢。
并发症:
并发尿毒症心力衰竭心律失常、感染出血、昏迷等。
老人糖尿病_老年人糖尿病肾病 -诊断
糖尿病肾病的诊断应符合下列条件:①较长的糖尿病史(一般至少5年以上才出现应激状态微量白蛋白尿,>10年才出现持续性微量白蛋白尿);②尿中出现微量白蛋白或尿蛋白阳性,并可排除高血压或其他肾脏疾病。因糖尿病肾病和糖尿病视网膜病变均属糖尿病微血管病变,故可同时合并存在糖尿病视网膜病变是诊断糖尿病肾病的有力佐证;有研究证实呈现肾病综合征的糖尿病肾病患者绝大多数(>90%)合并视网膜病变。
正常人尿蛋白总量<150mg/24h,而肾小球源性尿白蛋白总量<30mg/24h(或20μg/ml)尿蛋白<300mg/24h(或尿白蛋白<200μg/ml) 情况下用常规方法检测为阴性。应用敏感的放射性免疫法测定尿白蛋白,是诊断早期糖尿病肾病的重要指标。如当尿白蛋白>200μg/ml(或尿蛋白>300mg/24h),即为显性(临床)糖尿病肾病。
方法:1~6个月内收集3次24h尿标本,其中2次20~200μg/min(或30~300μg/24h),或者3次以上的24h尿测定UAER平均值在上述范围以内可以确定有持续性白蛋白尿。白蛋白尿>0.5g/24h,表明已进入临床肾病期DN的确切诊断要依赖肾活组织检查发现DN的组织病理改变――肾小球结节性硬化及弥漫性肾小球硬化。
鉴别诊断
糖尿病是常见病发病率为1%~2%糖尿病病人有时可合并存在与糖尿病无关的肾小球疾病或其他肾脏疾病,有研究报道糖尿病肾病替代治疗病人中20%为与糖尿病肾病无关的肾小球疾病凡有以下线索者必须认真鉴别:
①糖尿病病史<10年,呈现大量蛋白尿或肾病综合征;
②无糖尿病视网膜病变;
③尿镜检有大量红细胞,特别是红细胞管型;
④B超示双肾大小不对称,肾脏外形不规则或缩小。对有上述情况应仔细鉴别,必要时应作肾活检协助明确诊断。
1.糖尿病除合并肾脏病变外尚易伴发高血压、动脉粥样硬化等疾患以及合并酮症酸中毒、急性感染等,产生肾脏损害或引起肾脏暂时性功能性改变而造成程度不等的蛋白尿和细胞尿。一些与糖尿病无关的疾病,如红斑狼疮、急慢性肾炎亦可与糖尿病同时并存而造成DN的诊断困难。
2.青少年与儿童糖尿病病人出现蛋白尿主要应与急性和慢性肾炎鉴别。急性肾小球肾炎多有典型病史,除蛋白尿以外可有颜面或全身水肿如糖尿病病人在病情稳定、血糖控制良好的情况下突然出现水肿大量蛋白尿、伴或不伴肾功能恶化,要考虑伴发急性肾炎可能。
3.老年糖尿病有高血压、肾动脉硬化及心力衰竭时,也可有蛋白尿甚至出现类似于肾病综合征表现,但此时眼底检查主要为高血压及动脉硬化视网膜病变,而DN至临床蛋白尿期部分可合并糖尿病性视网膜病变,可资区别有人认为如果肾功能衰竭患者经散瞳仔细检查未发现糖尿病性视网膜病变,则应考虑其他原因。
4.糖尿病酮症酸中毒及糖尿病伴心力衰竭时可出现一过性蛋白尿。代谢紊乱或心力衰竭纠正后尿蛋白消失泌尿系统感染往往以尿中出现红细胞、白细胞为主,并伴有尿路刺激症状,感染急性发作控制后少量蛋白尿可减少或消失。糖尿病病人伴发其他疾病时亦可出现肾脏损害,如妊娠中毒症、系统性红斑狼疮及其他自身免疫病除蛋白尿以外多有原发疾病的临床表现。
5.肾脏穿刺活组织检查可以作DN特异性诊断依据但这只能在特殊情况下作鉴别诊断用。
老人糖尿病_老年人糖尿病肾病 -检查
1.微量白蛋白尿(UAER):老年人UAER变异较大,老年男性(11.4±2.6)μg/min,女性(8.2±2.2)μg/min其他情况如糖尿病失控、酮症酸中毒、尿路感染、肾炎高血压等亦可引起一过性或持续微量白蛋白尿故应排除这些情况。约80%微量白蛋白尿的IDDM患者和20%的NIDDM患者10年内进展为临床期肾病此外,该指标敏感性约78%,特异性约98%,故持续性微量白蛋白尿是临床肾病尤其IDDM临床肾病很好的预测指标。DN的微量白蛋白尿期尚存在可逆性,在此阶段如能干预治疗,去除不利因素,则肾病变有可能逆转和恢复,故近年大量研究集中该期及该期以前的检出和确定。WHO建议病程超过5年的IDDM和所有NIDDM患者均应每年测1次UAER如UAER升高,6个月内应连续测3次UAER,确定是否为早期DN微量白蛋白尿的产生是由于肾小球基膜上负电荷发生改变,加之肾小球、毛细血管内已经存在着的高滤过状态促使有高度选择性的小分子白蛋白尿。
测定白蛋白尿最好留取24h尿样因为1天中白蛋白排出并非持续和均匀,且最好间隔一段时间后重复,以除外某些因素,如尿路感染等的影响。但门诊患者留取24h尿多不便,经过比较发现尽管过夜12h尿确定早期DN的敏感性略低,但基本上可取代24h尿作UAER测定用于糖尿病受累的诊断分期,晨尿白蛋白浓度测定可首先用于DN的常规筛选检查,对>30μg/L者可进一步做过夜12h或24h UAER测定
2.微量转铁蛋白尿:1988年由Bernard等提出微量转铁蛋白尿亦可作为DN的早期诊断指标,有的研究提示转铁蛋白(TRF)排泄率(TER)可能较UAER更敏感。但目前尚未作为正式的早期诊断指标
TRF与白蛋白相对分子量相近,为77000,但其所带负荷比白蛋白少。DN极早阶段,肾小球滤过膜上所带负电荷已减少,而裂孔尚未变化,此时白蛋白尚不易滤出,而TRF已可能滤出,故数个研究报道认为TRF是DN较好的早期诊断指标,可能比UAER更为敏感。国内齐颖等比较了尿微量白蛋白和尿微量转铁蛋白对DN早期诊断意义,发现43.4%的患者见TER增高,而AER升高的患者仅为32.9%。
3.尿唾液酸:唾液酸(SA)又称N-乙酰神经氨酸(NANA),为肾小球毛细血管膜、基膜以及其他一些细胞膜的成分之一,相对分子量309.3,多以唾液酸的结合形式存
 爱华网
爱华网