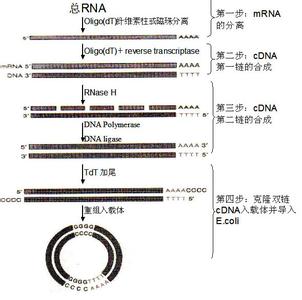
以mRNA为模板,经反转录酶催化,在体外反转录成cDNA,与适当的载体(常用噬菌体或质粒载体)连接后转化受体菌,则每个细菌含有一段cDNA,并能繁殖扩增,这样包含着细胞全部mRNA信息的cDNA克隆集合称为该组织细胞的cDNA文库。cDNA文库特异地反映某种组织或细胞中,在特定发育阶段表达的蛋白质的编码基因,因此cDNA文库具有组织或细胞特异性。
cdna_cDNA文库 -mRNA
制备
动物细胞mRNA的制备
植物细胞mRNA的制备
来源
选用mRNA含量高的组织材料,或通过药物等方法提高mRNA的含量
完整性
1、mRNA在无细胞翻译体系指导合成高分子量蛋白质的能力。无细胞翻译系统(Cell-free translation system),又叫体外转录-翻译的偶联系统,因为该系统需要制备无细胞提取物,还有人称之为"溶胞粗制品翻译系统"。
无细胞提取物的制备:
用机械的,超声波的,渗透压或用适当的去污剂等方法,将细胞溶破,再高速离心出去其质膜与细胞核等.该提取液中含有RNA聚合酶,核糖体,tRNA和能量发生系统.
常见的体外无细胞翻译系统:
兔网织红细胞系统。网织红细胞无细胞核,其合成的蛋白质90%以上为珠蛋白.
缺 点:已含有珠蛋白mRNA.可以在该体系中加入微球菌核酸酶和Ca2+,可很快分解,除去体系中的珠蛋白mRNA 。
麦胚系统用组织捣碎机将麦子捣碎,分离出麦胚.然后将粗制的麦胚加10倍体积的缓冲液与砂子共研磨.23000g离心所得的上清夜称为S23 ;将S23分装,保存于-20°C冰箱中.
利用麦胚系统进行蛋白质翻译合成研究时,需加的物质与网织红细胞系统相似.由于该体系无mRNA,所以必须加入mRNA。
优 点:适于研究mRNA,活力强,价格低廉等.
缺 点:不同制品的活性差别较大,且合成分子量较大(71X105 Dal)的蛋白质时往往提前终止.
哺乳动物mRNA在红细胞裂解液中翻译
*SDS-PAGEanalysis of proteins translated by cell-free translation system. Lane 1: protein marker; Lane 2,without mRNA; Lane 3 to 7: translation products of total mRNA from mammalian cells
2、mRNA在无细胞体系中指导合成目的多肽的能力
3、mRNA分子的大小
哺乳动物mRNA长度为500-8000bp,大部分mRNA位于1.5-2.0kb之间.
4、总mRNA指导合成cDNA第一链长分子的能力
利用哺乳动物细胞提取的poly(A)+RNA合成cDNA
*Lane 1: -HindIII-EcoRI; Lane 2: the first chain of cDNA;
Lane 3: the second chain of cDNA; Lane 4: -HindIII
丰度
1)高丰度mRNA
目的mRNA在细胞中的含量占细胞质总mRNA量的50-90%, 该类mRNA在合成和克隆cDNA之前不需进一步纯化特定mRNA .
2) 低丰度mRNA
目的mRNA在细胞中的含量占细胞质总mRNA量的0.5%以下.
5,mRNA的富集方法
典型的哺乳动物细胞含有10,000-30,000种不同的mRNA分子,某些mRNA分子在细胞内的拷贝数很低甚至只有一个拷贝.
mRNA的丰度与文库克隆子数的关系
ln(1-P)
N= ln(1-1/n)
N: 所需克隆数; P: 要求的概率; n:一种mRNA在总mRNA中的相对比例
1) 按大小对mRNA进行分级分离
* 通过琼脂糖凝胶电泳分离大小不同的mRNA分子,该方法的分离效果最好,但从凝胶中回收的得率较低.
* 蔗糖梯度离心:加入破坏RNA二级结构的变性剂如氢氧化甲基汞等,再进行蔗糖梯度离心以分离不同分子量的mRNA.
2) cDNA的分级分离
* mRNA通过反转录形成cDNA,在插入到克隆载体前,通过琼脂糖凝胶电泳,将不同大小的cDNA分子分离开来.
* 优 点:
a)避免了分离过程中mRNA被污染的RNA酶降解
b)增加了获得全长cDNA克隆的概率
c)获得更准确的分级分离效果(分子量)
3)多聚核糖体免疫学纯化法
* 使用抗体来纯化合成目的多肽的多聚核糖体.将正在合成的新生多肽链的多聚核糖体结合到免疫亲和柱(A蛋白-Sepharose柱)上,随后用EDTA将多聚核糖体解离下来,并通过Oligo(dT)层析分离mRNA, 利用该方法可将目的mRNA纯化数千倍. 目的mRNA在细胞中的含量可为数十拷贝.
分离
1.Oligotex mRNA Kits (QIAGEN)法
准备工作:
1.将Oligotex Suspension 置于37℃水浴中,旋转混匀,溶解Oligotex.,然后置于室温。
2.将OBB Buffer置于37℃水浴中,旋转混匀,重溶沉淀物,然后置于室温。
3.将OEB Buffer 置于70℃水浴中,待用。
试验步骤:
表3:加入试剂量据此表
Total RNARNase-free Water to:Buffer OBB(ul)OligotexSuspension (ul)Prep size<=0.25mg250ul250ul15Mini0.25-0.5mg500ul500ul30Midi0.5-0.75mg500ul500ul45Midi0.75-1.00mg500ul500ul55Midi1. Total RNA 量不要多于1mg,用移液器取出所需RNA量到1.5ml离心管中,加RNase-free water 补足到500ul
2. 根据表3加入适当体积的OBB Buffer和Oligotex Suspension, 轻弹1.5ml离心管彻底混匀
3. 置于70℃水浴中3min
4. 取出置于室温(20℃-30℃)10min
5. 13000rpm室温离心 2min,用移液器吸出上清到一个新的1.5ml离心管中,保留上清直到polyA被结合上。
6. 用移液器取400ul OW2 Buffer混匀沉淀物,将混合物转移到 Spin Column中,RT ,13000rpm,离心1min
7. 将Spin Column 转移到一个新的1.5ml离心管中,加400ul OW2,RT, 13000rpm,离心1min
9. 取出25ul OER Buffer(70℃)到Column中,用移液器吹打3-4次树脂,室温 13000rpm,离心1min。
10. 测OD,并电泳定量。
2.磁珠法分离mRN
1. 在RNase-free的Eppendorf 管中加入0.1~1.0mg的总RNA和RNase-free水至终体积为500ul.
2. 65ºC加热10分钟。
3. 加入3ul生物素标记的Oligo(dT)和13ul20×SSC于RNA中,轻轻混合,室温放置逐渐冷去至室温,一般需10 分钟左右。
4. 同时配0.5×SSC 1.2ml和0.1×SSC 1.4ml.
5. 将磁珠(SA-PMPs)轻晃散开,放入磁性分离架上,使SA-PMPs集中于管的一侧(约30sec),小心去上清,切不可离心。用0.3ml 0.5×ssc漂洗SA-PMPs,用磁性分离架集中磁珠,去除上清,重复3次。
6. 将漂洗后的SA-PMPs重新悬浮于0.1ml 0.5Xssc,注意漂洗后的SA-PMPs应在30分钟内使用。
7. 将(3)中的oligo(dT)/mRNA退火反应物全部加入含漂洗好的SA―PMPs管中,轻轻摇匀,室温下放10 分钟。
8. 用磁性分离架捕获SA-PMPs,小心去上清,但不要弃去。
9. 用0.1×SSC,每次0.3ml洗3次,每次都晃至SA-PMPs悬浮,最后一次漂洗后尽可能多的吸取水相,而不损坏SA-PMPs.
10.将SA-PMPs重新悬浮在0.1ml RNase-free水中,反复颠倒,使SA-PMPs散开,洗脱mRNA。
11.用磁性分离架捕获SA-PMPs,将洗脱的mRNA吸入另一个新的Eppendorf管中。
12.将SA-PMPs再悬浮于0.15ml RNase-free的水中,洗脱,与(11)步洗脱液合并。
13.将得到的mRNA溶液取几微升跑电泳,若mRNA浓度不足以进行下一步的反转录,则需将得到的mRNA溶液浓缩(浓缩步骤见14-18)。
14.加0.1体积的3mol/l NaAc和1.0体积的异丙醇于洗脱液中,-20ºC沉淀过夜。
15.4ºC,13000g离心60 分钟。去上清,加入500ul 70%乙醇混匀。
16.4ºC,7500g离心10 分钟。
17.去上清,真空或空气中自然风干,但不要太干,加适量RNase-free水溶解。
18.重复步骤5-12,将步骤8保留下的样品重新上柱
注意事项:
1.所有操作均需要严格戴手套,戴口罩进行
2.如果total RNA质量高,杂质少,就选择Oligotex的方法分离mRNA,相反则可以用磁珠法。
3.mRNA的电泳图是smear。
cdna_cDNA文库 -TRNA
TRNA提取
试剂配制
准备工作:
1、研钵、5ml/10ml/ 25ml移液管、100ml/250ml量筒、250ml/100ml容量瓶、药匙、试剂瓶等玻璃制品均用锡纸包裹口部,置于烤箱内,180℃,烤6小时。
2、50ml/1.5ml离心管、枪头等塑料制品用0.1‰DEPC水浸泡过夜后,121℃ 20mins 高压灭菌。
3、电泳槽及电泳托、梳子用3%双氧水处理。
4、常用试剂及其配方:
▲DEPC水:在1000ml去离子水中加入100ul DEPC, 静置过夜后高压灭菌。
▲0.78M柠檬酸纳:PH=4~5
三水合柠檬酸纳 22.94g
加DEPC水定容至100ml,室温放置备用。
▲10%肌氨酸钠:
肌氨酸钠10g
加DEPC水定容至100ml,室温放置备用。
▲变性裂解液:
0.78M柠檬酸钠 8.25ml
10%肌氨酸钠12.375ml
异硫氰酸胍118.05g
加DEPC水定容至 250ml,室温放置备用
临用前加β-巯基乙醇使其终浓度为1%(v/v)
▲ 2M 醋酸钠 PH=4.5
NaAc・3H2O 13.6g
加DEPC水定容至50ml,高压灭菌,室温放置备用
▲3M醋酸钠 PH=5
NaAc・3H2O 20.4g
加DEPC水定容至50ml,高压灭菌,室温放置备用
▲ 4M LiCL:
LiCL 24.164g
加DEPC水定容至100ml,高压灭菌,室温放置备用
▲0.5M EDTA PH=8.0
EDTA 18.61g
用NaOH调PH值至8.0,定容到100ml,高压灭菌,室温放置备用
▲10X MOPS (3-(N-吗啉代)丙磺酸):
MOPS 41.86g
NaAC・3H2O 4.10g
0.5MEDTA(PH 8.0) 20ml
用NaOH调PH值 6.5 , DEPC水定容到1L,室温避光放置备用。
▲ 1x MOPS:
10x MOPS 30ml
加DEPC水270ml,用时现配。
▲4x RNA Loading buffer:
10x MOPS 400ul
甘油(高压过) 200UL
溴酚兰 10ul
甲醛(37%) 72ul
去离子甲酰氨310ul
EDTA(0.5M PH 8.0) 8ul
ErBr(10mg/ml in DEPCH2O) 70ul
在4℃ 可保持3个月
▲ 10x PBS
pH=7.4
NaCl 80g
KCl 2g
Na2HPO4 14.4g
KH2PO4 2.4g
定容至 1000ml
▲变性电泳胶:
称取0.5g琼脂糖,加入47.5ml 1x MOPs,加热至琼脂糖熔化后,冷却至50℃左右,加入2.5ml甲醛,轻轻混匀后倒入电泳托上。
▲变性电泳缓冲液:
在250ml容量瓶内加入5ml甲醛,用1x MOPS定容至250ml
2.动物组织t RNA的提取
1. 根据表1选择适当的组织量和相应的变性裂解液量,将变性裂解液分装到RNase-free的50ml无菌离心管中,冰浴5分钟。
2. 将组织样品放入变性裂解液中,在高速下匀浆15-30秒/次,直到看不见组织和细胞碎片。
3. 根据表1加入适量2M的乙酸钠(pH4.0),反复颠倒混匀4-5次。
4. 根据表1加入适量酚/氯仿,加盖颠倒混合4-5次,再摇动10秒钟。
5. 冰浴10分钟。
6. 4°C,12000g离心20分钟。
7. 小心转移上层水相于另一个RNase-free的无菌离心管中,内含所需的RNA。蛋白质和DNA分别留在了有机相和中间层。
8. 加入等体积的异丙醇,-20°C沉淀30分钟以上。
9. 4°C,12000g离心20分钟。
10. 根据表1加入适量的变性裂解液重新溶解RNA。
11. 加等体积的氯仿,加盖颠倒混合4-5次,再摇动10秒钟。
12. 4°C,12000g离心20分钟。
13. 小心转移上层水相于另一个RNase-free的无菌离心管中,加入等体积的异丙醇,-20°C沉淀至少30分钟。
14. 4°C,12000g离心20分钟。
15. 弃上清,加1ml75%的乙醇漂洗RNA沉淀。4°C,12000g离心10分钟。
16. 弃上清,空气中干燥RNA沉淀,直至没有乙醇气味。用适量DEPC水充分溶解RNA沉淀。
17. 取少量RNA用于测定OD值及电泳,其余置-80°C冰箱中保存。
表 1
Mg# of tissue5008001000变性裂解液(ml)58102M NaOAC pH 4 (ml)0.50.81水饱和酚 (mL)5810氯仿 (mL)11.62异丙醇(mL)468变性裂解液 (mL)0.50.81异丙醇(mL)0.50.8175% 乙醇(mL)111DEPC-treated H20 (mL)0.50.813.植物组织t RNA的提取
1. 先将研钵于-80℃冰箱中预冷,然后将1g样品在液氮中研磨成粉末状。
2. 将粉末倒入盛有3ml变性裂解液的50ml离心管中,充分匀浆。(1g样品加入3ml变性裂解液)。
3. 加入0.3ml(1/10体积)2M的NaAc(ph4-5)颠倒混匀。
4. 加入3ml(等体积)的水饱和酚,充分振荡,再加入1ml(1/3)的氯仿,振荡。
5. 冰浴10min。4℃,12000g离心10min
6. 小心转移上清于另一离心管中,加入2倍体积的无水乙醇,-70℃沉淀至少1小时。
7. 4℃,12000g离心20min。
8. 去上清,取沉淀。加1ml 4M的LiCl 溶解沉淀(1mlLiCl/g组织),并转入1.5ml离心管中。
9. 4℃,13000rpm离心15min。
10. 用0.4ml DEPC水溶解沉淀,加1/2体积的水饱和酚,1/2体积的氯仿,颠倒混匀。
11. 4℃,13000rpm离心10min。
12. 取上清,加1/10体积的3MNaAc(ph5)和2倍体积的无水乙醇,-70℃沉淀30min以上。
13. 4℃,13000rpm离心15min。
14. 弃上清,用1ml 75%的乙醇洗涤沉淀,4℃,13000rpm离心10min。
15. 弃上清,取沉淀,空气中干燥RNA沉淀,直至无乙醇味。
16. 用40-60ul DEPC水溶解(300-500ug/g)RNA沉淀。
17. 取少量RNA用于测定OD值及电泳,其余置-80℃冰箱中保存。
4. TRIzol Reagent 提取total RNA(GIBCO)
1. 查表2根据样品量选择适当的 TRIzol Reagent体积装入50ml RNase-free离心管中,注意样品体积不能超过TRIzol Reagent体积的10%。
2. 将组织样品放入TRIzol Reagent中,高速下匀浆15-30秒/次,直至看不见组织和细胞碎片。
3.室温温育10分钟 。
4. 据表2加入适量体积的氯仿,剧烈震荡15秒钟,然后室温下温育3分钟。
5. 4ºC,12000g离心15分钟,形成淡红色的苯酚/氯仿有机相,中间相和上层水相,水相约占TRIzol体积的60%。
6. 转移上清于另一个Rnase-free的 50ml离心管中。根据表2加入适量异丙醇,-20ºC沉淀1小时以上。
7. 4ºC,12000g离心10分钟。
8. 去上清,据表2加入适量体积的75%的乙醇混匀。
9. 4ºC,7500g离心5分钟。
10. 去上清,空气中干燥或真空抽干RNA沉淀,但不要太干。加入适量体积的DEPC-WATER,溶解沉淀。
11. 取少量RNA用于测定其OD值和电泳,其余置-80ºC冰箱中保存。
表2
组织量TRIzol Reagent氯仿异丙醇75%乙醇50~100mg1ml0.2ml1ml1mlcdna_cDNA文库 -cDNA
cDNA双链合成
1. Superscipt II―RT合成第一链:
1. 在一RNase-free的0.2ml PCR管中,加入
xul mRNA(大约500ng)
1ul Xho I Primer(1.4ug/ul)
(5’ GAGAGAGAGAGAGAGAGAGAACTAGTCTCGAGTTTTTTTTTTTTTTTTTT…3’)
11-x ul RNase-free water
(大于500ng mRNA 分n管(500ng/tube)合成第一链, 第一链合成完毕后将n管合成一管进行第二链合成.)
2. 混匀后,70℃反应10分钟;
3. 反应完成后,立刻将反应体系置于冰上5min;
4. 稍微离心一下,顺序加入以下试剂:
4ul 5×first strand buffer
2ul 0.1M DTT
1ul 10mM dNTP(自己配制)
5. 混匀,稍微离心反应物之后,42℃放置2分钟;
6. 反应完成,趁热加入1 ul Superscipt II―RT,混匀;
7. 42℃反应50分钟,然后70℃,15分钟灭活反转录酶.
2. cDNA第二链的合成
1. 第一链反应完成后,取2ul一链产物-20℃冰箱中保存,待电泳检测。其余的产物合并,混匀,然后顺序加入下列试剂(promega):
20ul 10×DNA Polymerase I buffer
6ul 10mM dNTP(自己配制)
xul dd H2O
1ul RNase H(2U/ul)
10ul DNA Polymerase I(10U/ul)
总体系为200ul;
2. 混匀后,16℃反应2.5小时;
3. 70℃灭活10分钟;
4. 反应完成后,得到200ul cDNA第二链反应体系,将此体系置于冰上;
5.取2ul二链产物,同保存的一链产物一起电泳鉴定。同时上1kb ladder,确定双链的大小范围。
注:一链,二链的电泳图是smear,且二链稍比一链大一些。
3. 双链cDNA末端补平
1. 在第二链反应体系中,顺序加入下列试剂(promega):
6ul 10mM dNTP
2ul T4 DNA Polymerase(8.7U/ul)
2ul BSA(10mg/ml)
2. 稍微离心混匀反应物, 37℃反应至少30分钟,然后75℃灭活10分钟;
3. 加入等体积酚/氯仿/异戊醇,剧烈振荡后,常温下13000g离心5分钟;
4. 离心后,吸取上清于另一1.5ml eppendof管中,加入等体积氯仿,上下颠倒几次混匀后,常温下13000g离心5分钟;
5. 吸取上清至另一eppendof管,加入1/10V3M NaAc(PH5.2)和2.5V预冷的无水乙醇,混匀,-20℃放置过夜以沉淀双链cDNA;
6. 第二日,将昨日沉淀物在4℃,13000g离心60分钟以充分沉淀双链cDNA;
7.离心完毕,弃上清,加入1ml 70%乙醇洗涤沉淀,常温下13000g离心5分钟;
8.离心完毕,弃上清,干燥沉淀至无乙醇气味.
注:第3,第4步可以用PCR 纯化试剂盒代替。
PCR纯化试剂盒操作流程:
1.溶液PE使用前应加入适量体积95%-100%的乙醇,混匀。
2.向200ul二链补平产物中加入5倍体积的buffer PB,混匀。
3.加入spin column中,13000rpm离心1min。
4.加入0.75ml buffer PE,13000rpm离心1min。
5.13000rpm,再离心1min。
6.将spin column放入一新的离心管中,加入50ul buffer EB,静置10min。
7.13000rpm离心2min。
8.加入30ul buffer EB,静置10min。
9.13000rpm离心2min。
10.加入1/10体积3M的NaAc,2.5倍体积无水乙醇,混匀,-20℃沉淀过夜。
4 EcoR I adaptor 加接
1. 往双链cDNA沉淀中加入9ul EcoR I adaptor(400ng/ul),4℃至少放置30分钟以充分溶解cDNA沉淀;
2. 溶解完成后,顺序加入下列试剂:
1.2ul 10×Ligase Buffer
1ul 10mM rATP
1 ul T4 DNA Ligase(4U/ul)
3. 混匀后,4℃连接3days,或者8℃过夜连接;
5 双链cDNA末端的磷酸化及Xho I酶切
1. 连接反应完成后,将反应体系70℃放置15分钟灭活T4 DNA Ligase;
2. 稍微离心使反应物集中至管底,室温下放置5分钟,然后加入下列试剂:
1ul 10×Ligase Buffer
1ul 10mM rATP
6ul dd H2O
1ul T4 PNK(10U/ul)
3. 37℃反应30分钟,然后70℃灭活15分钟;
4. 稍微离心使反应物集中至管底;
5. 室温放置5分钟;然后加入下列试剂:
4ul Xho 10×Buffer
2ul BSA
5ul ddH2O
8ul Xho I (10U/ul)
6. 37℃反应1.5小时,然后65℃灭活酶10分钟;
7. 反应完成,双链cDNA合成完毕。置于4℃准备回收。
6.胶回收cDNA
1.配制小胶数板(每个样品一板):1%琼脂糖凝胶,2ul EB/300ml 胶
2.取4℃保存样品上样,40ul/孔。
3.电泳50V;1hr
4.紫外灯下分别切下500~1kb、1.0-2.0kb及2.0-4.0kb cDNA 片段.,分别放入已做标记的1.5ml离心管中。
5.称取胶重,加入三倍体积buffer QXI(例如,100mg胶中加入300ul buffer QXI)
6.50℃ 水浴数分钟,至胶完全融化。用手指弹 QIAEX II 使重悬,每管中加入5ul QIAEXII
7.50℃ 水浴10min,每隔2min 取出颠倒混匀数次,使QIAEX II 保持悬浮
8.4℃,13000rpm,30sec。(弃上清,离心机中甩一下,吸取上清)
9.加入500ul buffer QXI,轻弹管底使QIAEX II 重悬
10. 离心并去上清(同操作8)
11. 加入500ul buffer PE,重悬QIAEX II,离心30sec,去上清
12. 再加入500ul buffer PE,重悬QIAEX II,离心30sec,弃上清,离心机中甩一下,吸去上清
13. 超净台上吹干(至无乙醇味),加入10ul elution buffer,重悬QIAEX II,静置5min,13000rpm,30sec。吸上清,冰上放置。
14. 取1ul上清上样电泳,同时做分子量标准(1kb ladder)及DNA含量标准(10ng,20ng)作对照。
15. 将收回的cDNA置于-20℃内保存,据电泳结果,取适量DNA进行连接。
注意事项:
1.胶回收前电泳槽,电泳板,梳子等都要用1%的HCl浸泡过夜。
2.胶回收时电压要稳定。
第一链
第一链的合成
oligo(dT)引导的DNA合成法:
利用真核mRNA分子所具有的poly(A)尾巴的特性,加入12-20个脱氧胸腺嘧啶核苷组成的oligo(dT)短片段,由反转录酶合成cDNA的第一链.
缺 陷:
因为逆转录酶无法到达mRNA分子的5'-末端,必须从3'-末端开始合成cDNA.对于大分子量的较长的mRNA分子而言,特别麻烦.
随机引物引导的cDNA合成法 (randomly primed cDNA synthesis) :
根据许多可能的序列,合成出6-10个核苷酸长的寡核苷酸短片段(混合物),作为合成第一链cDNA的引物.在应用这种混合引物的情况下,cDNA的合成可以从mRNA模板的许多位点同时发生,而不仅仅从3'-末端的oligo(dT)引物一处开始.
第二链
第二链的合成
第一链的合成反应完成后,得到DNA/RNA杂交分子,在DNA聚合酶的作用下,以第一链为模版,合成cDNA的第二链。
自身引导
变性降解除去杂交分子中的RNA,单链cDNA的3'端能够形成发夹状的结构作为引物,在大肠杆菌聚合酶I Klenow或反转录酶的作用下,合成cDNA的第二链.
缺 点:
在以S1核酸酶切割cDNA的发夹状结构时,会导致对应于mRNA 5'端的地方的序列出现缺失和重排. S1核酸酶的纯度不够时,会偶尔破坏合成的双链cDNA分子.
自身引导法合成双链cDNA
置换合成
原 理:
以第一链合成产物cDNA:mRNA杂交体作为切口平移的模板,RNA酶H在杂交体的mRNA链上造成切口和缺口,产生一系列RNA引物,在大肠杆菌DNA聚合酶I的作用下合成cDNA的第二链.
优点:a)合成cDNA的效率高
b)直接利用第一链的反应产物,不需纯化
c)避免使用S1核酸酶来切割双链cDNA
3,引物-衔接头法
cdna_cDNA文库 -克隆
将合成的双链重组到质粒载体或噬菌体载体上,转化大肠杆菌寄主细胞增殖.
1,同聚物加尾法
利用小牛胸腺末端转移酶在双链cDNA和质粒载体的3'-端都加上一个互补的同聚片段,通过退火使两个片段连接成重组质粒,再将重组质粒转化受体细胞.
同聚物加尾法克隆双链cDNA
2,接头-衔接头法
3,mRNA-cDNA克隆法
方 法:
在mRNA反转录合成cDNA第一链后,将dA残基加到mRNA:cDNA杂交体上,然后与带dT尾的克隆载体连接,转化受体细胞,在宿主细胞内,mRNA被降解并代之以DNA.
缺 点:
克隆的效率低(为双链cDNA克隆的1/10)
4,Okayama-Berg法合成并克隆双链cDNA
cdna_cDNA文库 -载体制备
1.pBlueScriptII的提取
1.取1ul商品的pBlueScriptII,转化入大肠杆菌宿主菌中,取5ul转化产物均匀涂布在含AMP的LB平板上,37℃培养过夜。
2.第二天取一只无菌的50ml离心管,加入10ml AMP抗性的LB液体培养基,挑单克隆于离心管中,37℃,250rpm,培养过夜。
3.第三天取200µl小摇后的菌液接种于250ml 含AMP的LB液体培养基中,37℃,250rpm培养6 hr左右,使OD值达到0.6-0.8。
4.将菌液移入250ml离心管中, 4℃,3000rpm,离心15min。取出离心管,菌团朝上倒掉上清,将离心管倒置于吸水纸上使上清充分滤干。(注意离心前需配平)
5.加入10ml溶液Ⅰ(50mM Glucose , 25mM Tris-HCl,10mM EDTA, pH8.0),加入RNase至终浓度100µg/ml,晃动摇菌,使菌体充分悬浮,静置10min。
6.按NaOH(0.4N):SDS(2%)--1:1的比例新鲜配制溶液Ⅱ,加入20ml溶液Ⅱ,静置3-5min。
注: 静置时间勿超过5min,提前将溶液Ⅲ置于冰盒中。
7.加入15ml冰浴的溶液Ⅲ,冰浴15-30min。
8.4℃,5000rpm,离心15min。
9.取上清于两个50ml离心管中,弃去原离心管中的沉淀。
10.每管加入0.6倍体积的异丙醇,充分混匀,室温下放置10min。
11. 20℃,12000g,离心20min回收质粒沉淀。
12.弃上清,用70%的乙醇洗2次。
13.弃上清,倒扣于吸水纸上,尽量空干液体。
14.用3ml TE(pH8.0)溶解沉淀,移入1.5ml Eppendorf离心管中。
15.电泳检查DNA质量并定量。(必要的话,可以用胶回收的方法先纯化一下质粒再进行双酶切。)
2.pBlueScriptII的双酶切消化
1.以如下体系进行EcoRI酶切:
pBSK(+) X µl(6µg)
ddH2O 174-X µl
10×Buffer E 20 µl
混匀,加入限制性内切酶:
EcoRI (10U/ µl) 6 µl
总体积为200 µl。
2.轻弹管壁或用枪头轻轻吹打混匀,在离心机上甩一下。
3.37℃,水浴1hr。
4.加入200ul 1:1的酚/氯仿,混匀。4℃,13000rpm,离心15min。
5.取上清,加入等体积的氯仿,4℃,13000rpm,离心10min。
6.取上清,加入0.1倍体积的NaAC和2.5倍体积的无水乙醇,-20℃,沉淀30min。
7. 4℃,13000rpm,离心10min,弃上清,取沉淀。
8.加入200ul 70%的乙醇洗沉淀。
9.4℃,13000rpm,离心10min,弃上清,取沉淀。
10.自然风干沉淀,至无乙醇味,加入100ul ddH2O充分溶解沉淀。
11.加入以下试剂进行XhoI酶切:
ddH2O 74 µl
10×Buffer D 20 µl
混匀,加入限制性内切酶XhoI:
XhoI (10U/ µl) 6 µl
总体积为200 µl。
12.轻弹管壁或用枪头轻轻吹打混匀,在离心机上甩一下
13.37℃,水浴1.5hr。
14.加入200ul 1:1的酚/氯仿,混匀。
15.4℃,13000rpm,离心15min。
16.取上清,加入等体积的氯仿,4℃,13000rpm,离心10min。
17.取上清,加入0.1倍体积的NaAC和2.5倍体积的无水乙醇,-20℃,沉淀30min。
18. 4℃,13000rpm,离心10min,弃上清,取沉淀。
19.加入200ul 70%的乙醇洗沉淀。
20.4℃,13000rpm,离心10min,弃上清,取沉淀。
21.自然风干沉淀至无乙醇味,加入40ulddH2O充分溶解沉淀,得到双酶切载体。
3.载体去磷酸化
1.在40ul双酶切载体中加入以下试剂:
6ul 10×buffer
6ul CIAP(0.01U/ul)
8ul ddH2O
总体积60ul。
2.轻弹管壁或用枪头轻轻吹打混匀,在离心机上甩一下。
3.37℃,水浴1hr。
4.70℃,15min,灭活酶。
5.电泳分离,胶回收双酶切载体,定量。
4.载体效率检测
1.按以下所示作4个连接反应:
DNA连接酶
1pBlueScriptII/E/X /CIAP-检测酶切效率2pBlueScriptII/E/X /CIAP+检测脱磷效率,载体自连效率3商品Vector加标准Insert+对照4自制Vector加标准Insert+检测载体效率
14℃连接过夜。
2. 各取1ul连接产物作电转化(具体流程见电转化)
3.计算克隆数,计算载体相对脱磷效率及连接效率。
cdna_cDNA文库 -鸟枪法
又叫霰弹法,其特点是绕过直接分离基因这一关.由于目的基因在整个基因组中太少太小,在相当程度上靠"运气".
原 理:
基因组DNA
物理(剪切力,超声波等) 或生化方法(限制性内切酶)切割
长度与一般基因大小相当的DNA片段的混合物
随机地重组入适当的载体
转 化
大肠杆菌中扩增
适当的方法筛选
要求有简便的筛选方法:
利用特定基因缺陷型(如营养缺陷型等)的受体细胞,或特定的寡核苷酸DNA 片段探针以特定基因产物的抗体,可通过双表型的筛选或用分子杂交技术,免疫筛选技术检出目的基因.
示例:面包酵母吲哚甘油磷酸脱氢酶基因的制取
EcoRI 载体
酵母DNA 片段基因 重组DNA
转化
"吲哚甘油磷酸脱氢酶型组氨酸缺陷型"大肠杆菌
基本培养基
筛选,分离菌株
目的基因
cdna_cDNA文库 -物化方法
基因工程初始阶段所用的方法,已不用.利用核酸双螺旋之间存在着碱基G C,A T配对特性,分离目的基因.
例如:海胆rDNA分子内其G C含量可以达63%(其稳定性高,溶解温度高),通过热变性和S1酶解处理可得到提纯50倍的rDNA,最后经氯化铯平衡梯度离心,得到相对分子量为1.9X107Dal的高纯rDNA.
从基因文库中分离目的基因
cdna_cDNA文库 -分离基因
如果手中有足够量可产生抗体的来源于真核细胞的蛋白质,可以通过双抗体免疫法分离出此蛋白的基因.
基本原理:
核糖体沿mRNA进行多肽链合成时形成多聚核糖核蛋白体,而具有不同长度的新生肽链在核糖体上不断延伸;
将从细胞匀浆液中制备出的多聚核糖核蛋白体同特定抗体一起保温,形成多聚核糖体同抗体的复合体;
当加入特定蛋白的抗体产生的第二抗体时,产生沉淀,就可以通过不连续蔗糖梯度离心,将所要的含有特定的mRNA的多聚核糖体同总多聚核糖体分离;再通过酚,氯仿抽提去除蛋白及oligo-dT柱亲合层析,就可以得到为特定蛋白编码的mRNA,再通过反转录得到cDNA.
cdna_cDNA文库 -化学合成
基因的化学合成
基因片段的全化学合成
首先合成一个基因的所有片段,相邻的片段间有4―6个碱基的重叠互补,退火后,用T4DNA连接酶将各片段以磷酸二酯键的共价键形式连接成一个完整的基因.
基因的化学―酶促合成
不需要合成完整基因的所有寡核苷酸片段,而是合成其中一些片段,相邻的3'-末端有一短的顺序相互补,在适当的条件下通过退火形成模板―引物复合体,然后在存在四种的条件下,用大肠杆菌DNA聚合酶I大片段填补互补片段之间的缺口,最后用T4DNA连接酶连接及适当的限制性内切酶.
cdna_cDNA文库 -PCR
PCR技术的应用
目的基因的直接克隆
与常规的基因克隆方法相比,PCR的优点是快速,简单,但是用PCR克隆目的基因的限制是必须知道侧接靶序列的核苷酸序列,以制备引物.因而该法具有很大的局限性.
可直接利用具有平端的PCR产物进行克隆,但利用合适的引物,在待克隆的目的基因二侧引入不同的限制性酶切点,则可将扩增之后的目的基因定向克隆到载体中,避免载体的自身环化,提高克隆效率.
cDNA的克隆
利用PCR技术,只需增加一步逆转录反应,便可从少数mRNA的构建cDNA文库,以mRNA为模板,以oligo(dT)为引物,在依赖于RNA 的DNA聚合酶催化下体外合成cDNA第一链之后,可通过PCR扩增此链.
如在此链的3'端再加上一段鸟苷酸残基同聚物,则可以使用oligo(dT)和oligo(dC)作为后续PCR扩增的引物,也可酌情在这些引物的5'端加上限制性酶切点,以利于将所得的双链DNA克隆到适当的载体中.
在某些情况下,如已知RNA(或其基因)两端的核苷酸序列,mRNA5'端核苷酸序列或其编码的蛋白质N端的氨基酸序列,便可设计特定的两端引物,用于直接克隆特定的目的基因cDNA,从而省略从cDNA文库中筛选cDNA克隆等序列费时的操作.
 爱华网
爱华网