化学方程式,也称为化学反应方程式,是用化学式表示化学反应的式子。化学方程式反映的是客观事实。因此书写化学方程式要遵守两个原则:一是必须以客观事实为基础;二是要遵守质量守恒定律。用化学式(有机化学中有机物一般用结构简式)来表示物质化学反应的式子,叫做化学方程式。化学方程式不仅表明了反应物、生成物和反应条件。同时,化学计量数代表了各反应物、生成物物质的量关系,通过相对分子质量或相对原子质量还可以表示各物质之间的质量关系,即各物质之间的质量比。对于气体反应物、生成物,还可以直接通过化学计量数得出体积比。V=M/ρ。
化学反应方程式_化学方程式 -要点

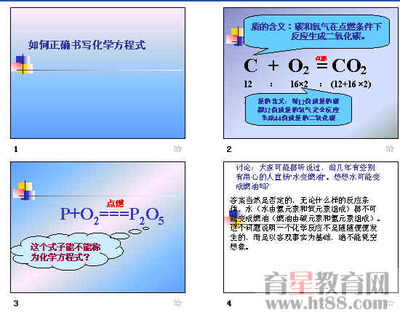
化学方程式书写步骤
1.写出反应物和生成物的化学式。
例:NaHCO3=Na2CO3+H2O+CO2↑
2.配平。
例:2NaHCO3=Na2CO3+H2O+CO2
3.注明反应条件和物态等。
例:2NaHCO3=Na2CO3+H2O+CO2↑
4.检查化学方程式是否正确。
反应条件
1.热化学方程式不写反应条件。写上是否正确,没有定论,但中学所有资料中不写。配平系数也可以不是1,可以是分数或者相互之间可以约分。
2.常温常压下可以进行的反应,不必写条件;但是题目中的实验若有特定的条件,一律标注该特定条件。
3.反应单一条件时,条件一律写上面;有两个或更多条件的,上面写不下的写在下面;既有催化剂又有其它反应条件时,一律把催化剂写在上面。
4.是可逆反应的一律用双向箭头表示。
箭头与等号
在专业领域的文献中,不论无机、有机反应方程式中均使用箭头号“→”来连接反应物和生成物。国外化学教科书、上海市中学化学二期课改教材(上海科学技术出版社2006年7月,姚子鹏主编)、上海高考的化学卷、理综卷中也采用了箭头号。但在多数省市的中学教学中,仍建议按照教材在书写无机化学反应方程式时使用等号,以更好地表示反应中的“生成”与“质量守恒”含义。(2011-2012苏教版也用的箭头)
2013年中学阶段无机反应方程式一律用等号连接反应物和生成物,有机反应一律用箭头来连接反应物和生成物,是可逆反应的一律用双向箭头表示。
气体符号与沉淀符号
1.气体符号“↑”和沉淀符号“↓”是化学反应中生成物的状态符号。只有生成物才能使用“↑”或“↓”符号,使用时写在相应化学式的右边。
2.当生成物在常温常压下(通常指25℃、101.3kPa)是气态的,才用“↑”号,如:
NH4HCO3=Δ=NH3↑+H2O+CO2↑
,但还必须同时注意两点:
(1)若反应物中有一种或几种气态物质(常温常压下)则生成的气态物质不再用“↑”号,如:
C+O2=点燃=CO2
CH4+2O2=点燃=CO2+2H2O
(2)不论反应物状态如何,只要产物只有一种物质,且是气体时也不用“↑”。
3.在溶液中进行的化学反应,有难溶物质或不溶物质生成时,用“↓”号表示。如:
HCl+AgNO3==AgCl↓+HNO3
4.若反应不是在溶液中进行的,就不存在沉淀析出现象,不能用“↓”号。如:2HgO=△=2Hg+O2↑
5.对于金属与盐溶液之间的置换反应,生成的金属单质,由于覆盖在金属的表面,没有沉淀析出,不应使用“↓”号,如:Fe+CuSO4==FeSO4+Cu
6.在复分解反应中,若生成物是微溶物时,应把它视为“沉淀”,标上“↓”。如:MgSO4+Na2CO3==Na2SO4+MgCO3↓
7.必须以客观事实为依据,即使是同一个化学反应,也必须要看具体情况。如硫化氢与二氧化硫气体混合反应生成硫,不用沉淀符号,即2H2S+SO2==2H2O+3S
当把二氧化硫通入到氢硫酸的溶液中时,溶液中出现了黄色的浑浊现象,生成的单质硫应标上“↓”,即2H2S+SO2==2H2O+3S↓
又如向氯化银悬浊液中滴加硫化钠溶液,白色沉淀变成黑色,发生了沉淀的转化,生成的硫化银应标上“↓”,即2AgCl+Na2S==Ag2S↓+2NaCl
物质状态
化学方程式热化学
加热化学方程式需要标出每一个反应物、生成物的状态,可分g(气体)、l(液体)、s(固体)、aq(溶液)四大类。字母外需要打括号,例如H?O(l)、Na?CO?(aq)、CaCO?(s)。
普通方程式则不是很严格,一般不用g、l、s、aq的标记。生成物方面,当反应物中不含气体时,气体生成物要用“↑”标记;只有在溶液中,反应物中不含固体时,难溶或固体生成物一律用“↓”标记(如电解池反应:CuCl?=Cu+Cl?↑,由于生成Cu吸附在电极上,故不写“↓”)。
水蒸气
水蒸气一般不打箭头,但偶有例外(碳酸氢铵受热分解)。
反应物状态的不同
反应物若以特殊状态参加反应,例如浓硫酸、熔融氧化铝,过量,少量,一律在相应的反应物后打括号注明状态
<1>反应物的浓度不同,产物不同
Cu+4HNO?(浓)=Cu(NO?)?+2NO?↑+2H?O
3Cu+8HNO?(稀)=3Cu(NO?)?+2NO↑+4H?O
<2>反应物的量不同,产物不同
2NaOH+CO?(少量)=Na?CO?+H?O
NaOH+CO?(过量)=NaHCO?
<3>反应物的物态不同,产物不同
2NaCl+2H?O=通电=2NaOH+H?↑+Cl?↑
2NaCl(熔融)=通电=2Na+Cl?↑
化学方程式中,有机物需要用结构简式燃烧反应无需考虑有机物结构,因此理论上可以写分子式。(但还是写结构简式为妙。)
个别相对复杂的有机物允许写分子式(例如葡萄糖),但是在相应的分子式下方要用中文注明反应物名称,并打括号。
无机物一般使用分子式而不用结构简式(例如硝酸通常不写为HO-NO2)。
化学反应方程式_化学方程式 -正文
用化学式表明化学变化的式子,也称化学反应式。例如氢气和氧气发生化学变化生成了水,可以用下列化学方程式表示:化学方程式反应物的化学式写在左边,生成物(也叫产物)的化学式写在右边,中间以等号相连。按质量守恒定律,反应前后各元素原子数目不变,所以各化学式前面应加上适当的系数,使方程式两边的原子数目相等。例如在上式中H2的系数为2,O2为1,H2O为2,则左边和右边都是4个氢原子和2个氧原子。在讨论化学平衡问题时常用
代替
以强调反应的可逆性。也有时用─→代替
,以强调反应的单向性,或用─→表示同时发生副反应。
化学方程式不仅表明反应物、生成物各是哪些物质,而且还表明了它们之间的质量关系。如上述化学方程式表示2摩尔H2和1摩尔O2起反应,生成了2摩尔H2O, 也表示4.03176克氢气和31.9988克氧气起反应,生成了36.03056克的水。所以,按照化学方程式可以进行基本化学计算。
电解质在水溶液里电离成离子,离子间的化学变化可以用离子化学方程式表示。例如氯化钡溶液和硫酸钠溶液相作用,发生反应的是钡离子和硫酸根离子,所以它们的离子化学方程式是:
Ba+SO
 爱华网
爱华网