历史早在上世纪60年代,麦金太尔((McIntyre)和埃尔里克(Elrick)等人就发现,口服葡萄糖对胰岛素分泌的促进作用明显高于静脉注射,这种额外的效应被称为“肠促胰素效应”,而珀利(Perley)等人进一步研究证实,这种“肠促胰素效应”所产生的胰岛素占进食后胰岛素总量的50%以上。1986年,瑙克(Nauck)等人发现,2型糖尿病患者肠促胰素作用减退,这提示,肠促胰素系统异常可能是2型糖尿病的发病机制之一。随着细胞和分子生物学的发展,肠促胰素这层神秘的面纱被慢慢揭开,研究证实,肠促胰素是人体内一种肠源性激素,在进食后,该类激素可促进胰岛素分泌,发挥葡萄糖浓度依赖性降糖作用。肠促胰素主要GLP-1和糖依赖性胰岛素释放肽(GIP)组成,其中GLP-1在2型糖尿病的发生发展中起着更为重要的作用。GLP-1由胰高血糖素原基因表达,在胰岛α细胞中,胰高血糖素原基因的主要表达产物是胰高血糖素,而在肠黏膜的L细胞中,前激素转换酶(PC1)将胰高血糖素原剪切为其羧基端的肽链序列,即GLP-1。。GLP-1有2种生物活性形式,分别为GLP-1(7-37)和GLP-1 (7-36)酰胺,这两者仅有一个氨基酸序列不同,GLP-1约80%的循环活性来自GLP-1(7-36)酰胺[1,2]。
glp_GLP-1 -特性介绍
怎样发挥降糖效应
研究已证实,肠促胰素以葡萄糖浓度依赖性方式促进胰岛β细胞分泌胰岛素,并减少胰岛α细胞分泌胰高血糖素(glucagon),从而降低血糖。正常人在进餐后,肠促胰素开始分泌,进而促进胰岛素分泌,以减少餐后血糖的波动。但对于2型糖尿病患者,其“肠促胰素效应”受损,主要表现为进餐后GLP-1浓度升高幅度较正常人有所减小,但其促进胰岛素分泌以及降血糖的作用并无明显受损,因此GLP-1及其类似物可以作为2型糖尿病治疗的一个重要靶点[3,4]。GLP-1主要通过以下几方面发挥降糖作用。
GLP-1具有保护β细胞的作用 GLP-1可作用于胰岛β细胞,促进胰岛素基因的转录、胰岛素的合成和分泌,并可刺激胰岛β细胞的增殖和分化,抑制胰岛β细胞凋亡,增加胰岛β细胞数量[2-5]。此外,GLP-1还可作用于胰岛α细胞,强烈地抑制胰高血糖素的释放,并作用于胰岛δ细胞,促进生长抑素的分泌,生长抑素又可作为旁分泌激素参与抑制胰高血糖素的分泌。
研究证明,GLP-1可通过多种机制明显地改善2型糖尿病动物模型或患者的血糖情况,其中促进胰岛β细胞的再生和修复,增加胰岛β细胞数量的作用尤为显着,这为2型糖尿病的治疗提供了一个非常好的前景。
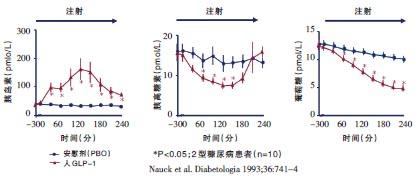
GLP-1具有葡萄糖浓度依赖性降糖作用 作为一种肠源性激素,GLP-1是在营养物质特别是碳水化合物的刺激下才释放入血的,其促胰岛素分泌作用呈葡萄糖浓度依赖性,Nauck等对10例血糖控制不佳的2型糖尿病患者进行了研究,并在空腹状态下分别给予患者GLP-1或安慰剂,结果显示,患者在输注GLP-1后,其胰岛素和C肽水平显着增加,胰高血糖素水平显着降低,空腹血糖水平在4小时后变为正常。在血糖水平正常后,虽然仍持续输注GLP-1,患者的胰岛素水平却不会再升高,血糖水平也维持稳定,不再进一步下降。这说明GLP-1具有葡萄糖浓度依赖性降糖作用,即只有在血糖水平升高的情况下,GLP-1才发挥降糖作用,而在血糖水平正常时,则不会使其进一步降低。GLP-1的这种葡萄糖浓度依赖性降糖特性是其临床应用安全性的基础与保障,从而免除了人们对现有糖尿病治疗药物及方案可能造成患者严重低血糖的担心。
GLP-1具有减轻体重的功效 灿德尔(Zander)等研究显示,在接受GLP-1治疗6周后,参与研究的20例2型糖尿病患者的体重平均减轻了1.9 kg。研究者认为,GLP-1是通过多种途径产生降低体重的作用,包括抑制胃肠道蠕动和胃液分泌,抑制食欲及摄食,延缓胃内容物排空。此外,GLP-1还可作用于中枢神经系统(特别是下丘脑),从而使人体产生饱胀感和食欲下降。
除此之外,GLP-1还具有许多其他生物学特性及功能,例如,GLP-1可能发挥降脂、降压作用,从而对心血管系统产生保护作用;它还可通过作用于中枢增强学习和记忆功能,保护神经。
glp_GLP-1 -面临问题
未来发展方向如何
然而,要将GLP-1应用于临床也面临着问题,那就是人体自身产生的GLP-1 极易被体内的二肽基肽酶Ⅳ(DPP-Ⅳ)降解,其血浆半衰期不足2分钟,必须持续静脉滴注或持续皮下注射才能产生疗效,这大大限制了GLP-1的临床应用。
为解决这一难题,学者们已经提出两种方案,一是开发GLP-1类似物,让其既保有GLP-1的功效,又能抵抗降解;二是开发DPP-Ⅳ抑制剂,使体内自身分泌的GLP-1不被降解。目前,这两方面研究都已经取得了一定的进展。相信随着人们对GLP-1信号系统研究的深入,会发现更多新的作用靶点,从而开发出更多治疗糖尿病的新型药物,以造福糖尿病患者.
 爱华网
爱华网