保列治?(非那雄胺片),处方药,由默沙东公司(在美国和加拿大被称为默克)研发、生产,1994年获准在中国上市。保列治?属于5-α还原酶抑制剂,是最常用于治疗良性前列腺增生症(简称BPH)的药物,通过激素调节机制缩小前列腺体积,缓解症状,增加尿流率,并延缓疾病进展。美国,欧洲以及中国的三大指南都推荐使用非那雄胺治疗BPH。 2006年,中国《BPH诊断治疗指南》问世,推荐了非那雄胺作为治疗前列腺增生的基本药物,使得中国泌尿学界在前列腺增生的诊疗方面与世界接轨 。
保列治_保列治 -药品信息
【通用名】:非那雄胺片
【商品名】:保列治(PROSCAR)
【汉语拼音】名:Feinaxiongan
【英文名】:Finasteride
【规格】5mg
【包装】铝塑板包装,10片/盒,10片*2板/盒
【有效期】 36个月
【执行标准】 JX20060063
【进口药品注册证号】 H20110485
【生产企业】
公司名称:Merck Sharp & Dohme Limited
地址:Hertford Road, Hoddesdon, Hertfordshire, EN11 9BU, United Kingdom
生产厂名称: MSD International GmbH (Puerto Rico Branch) LLC
地址:Road #2, Kilometer 60.3, Sabana Hoyos, Arecibo, PR 00688, Puerto Rico
包装厂名称:Merck Sharp & Dohme Limited
地址:Shotton Lane, Cramlington, Northumberland, NE23 3JU, United Kingdom
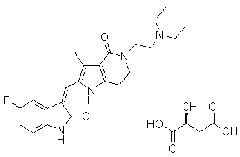
【化学名称】: N-(1,1-二甲基乙基)-3-氧-4-氮杂-5-甾-1-烯-17-酰胺
【化学结构式】:
保列治
【分子式】:CHNO
【分子量】:372.55
【性状】
本品为异形薄膜衣片,除去包衣后显白色或类白色
适应症
1、本品适用于治疗和控制良性前列腺增生(BPH)以及预防泌尿系统事件
―降低发生急性尿潴留的危险性。
―降低需进行经尿道切除前列腺(TLRP)和前列腺切除术的危险性。
2、本品可使肥大的前列腺缩小改善尿流及改善前列腺增生有关的症状,前列腺肥大患者适用于本品治疗。
用法用量
推荐剂量是每天1片,每片5毫克,与或不与食物同服。
肾功能不全患者剂量
对于各种程度不同的肾功能不全患者肌酐清除率低至9毫升/分钟)不需调整给药剂量,因为药代动力学研究证实非那雄胺的体内过程没有任何改变。
老年人剂量
尽管药代动力学研究显示70岁以上患者非那雄胺的清除率有所降低,但不需调整给药剂量。
不良反应
本品具有良好的耐受性。
在PLESS研究中,对1 524名患者每天服用5毫克本品,和1516名患者服用安慰剂,进行了为期4年多的安全性评价。4.9%(74名患者)由于与本品有关的不良反应而中断治疗,与之相比,安慰剂组是33%(50名患者)。服用本品的患者中37%(57名患者)以及安慰剂治疗的患者中2.1%(32名患者)由于与性功能有关的不良反应而中断治疗,这是报道最多的不良反应。
在4年多的研究中,被研究人员认为可能,很可能和确定与本品有关,发生率≥1%且大于安慰剂的临床不良反应主要是性功能受影响、乳房不适和皮疹。在研究的第一年中,服用本品的患者8.1%发生阳痿,而用安慰剂的患者为3.7%;性欲降低者为6.4比3.4%,射精降碍为0.8比0.1%。在研究的第二至第四年中,两个治疗组间这三种不良反应的发生率没有明显差异。第二至四年的累积发生率:阳痿(本品5.1%;安慰剂5.1%);性欲降低(2.6%;2.6%);射精障碍(0.2%;0.1%)。在第一年中,用本品和安慰剂射精量减少的患者分别为3.7和0.8%;在第二至四年中,累积发生率本品为1.5%、安慰剂为0.5%。在第一年中,报道本品组和安慰剂组出现乳腺增生为(0.5%;0.1%),乳房触痛(0.4%;0.1%)以及皮疹(0.5%;0.2%)。第二至四年的累积发生率:乳腺增生(1.8%;1.1%);乳房触痛(0.7%;0.3%);及皮疹(0.5%;0.1%)。
在为期1年、安慰剂对照的III期临床研究以及五年延长期(853名患者延长治疗至五到六年)的研究中,不良反应的情况与在PLESS中二至四年的报道相似。未发现随本品治疗期延长而增的不良反应。新出现的与药物有关的性功能方面的不良反应的发生率随治疗时间的延长而降低。
其他长期研究资料
在一项为期7年,安慰剂对照的临床研究中,共人选了18,882名健康男性。在其中9060名男性进行前列腺针吸活组织检查的数据分析中,观察到前列腺癌的发生在本品中有803名(18.4%);在安慰剂组中有1147名(24.4%)。通过前列腺针吸活检资料发现患前列腺癌在Gleason评分为7-10的在本品组中有280名(6.4%),而在安慰剂组中有237名(5.1%)。进一步分析显示在本品组的高评分前列腺癌病人的增加可能由于因为本品对前列腺体积的作用而产生的检测偏差而引起。在此项研究中所有被诊断为前列腺癌的病例中,大约98%的病人在诊断时被归类为囊内肿瘤(临床T1期或T2期)。Gleason评分7-10的临床意义尚不清楚。
乳腺癌
在入选了3047名男性、为期4-6年,与安慰剂和对照药进行对照的MTOPS研究中,接受非那雄胺治疗的男性中有4例乳腺癌病例,未接受非那雄胺治疗的男性中没有乳腺癌病例。在入选了3040名男性、为期4年、安慰剂对照的PLESS研究中,接受安慰剂治疗的男性中有2例乳腺癌病例,但接受非那雄胺治疗的男性中没有乳腺癌病例。在入选了1 8882名男性、为期7年、安慰剂对照的前列腺癌预防试验(PCPT)中.接受非那雄胺治疗的男性中有1例乳腺癌病例,接受安慰剂治疗的男性中有1例乳腺癌病例。已有关于使用非那雄胺的男性中发生乳腺癌的上市后报告。非那雄胺的长期使用与男性乳腺肿瘤形成之间的关系尚未知。
产品上市后经验
以下是产品上市后报道的与保列治和/或低剂量非那雄胺有关的不良反应。由于这些不良反应是规模不确定的人群自发报告的,因而有时不可能对其发生率进行可靠地评估,或者确定其与药物暴露之间的因果关系。
免疫系统疾病:超敏反应,例如瘙痒、风疹及血管性水肿(包括唇部,舌头,咽喉及面部肿胀)。
精神疾病:抑郁,停止治疗后继续存在的性欲降低。
生殖系统和乳腺疾病:在停止治疗后继续存在的性功能障碍(勃起功能障碍及射精异常),睾丸疼痛,男性不育和/或精液质量差。已有报告称停止非那雄胺用药后精液质量恢复正常或出现改善。
实验室化验结果
评价实验室检查结果时,应考虑到服用本品的患者(见注意事项)PSA水平降低的情况。
服用本品或安慰剂的患者中,标准实验室参数没有其它差别。
禁忌
本品不适用于妇女和儿童。
本品禁用于以下情况:
.对本品任何成份过敏者。
.妊娠――怀孕和可能怀孕的妇女(见孕妇及哺乳期妇女用药)。
注意事项
一般注意事项
对于有大量残留尿和/或严重尿流减少的患者,应该密切监测其堵塞性尿路疾病。
对PSA及前列腺癌检蠢的影响
目前为止,用本品治疗前列腺癌患者还未见临床疗效。在对照的临床研究中,通过系列PSAs和前列腺活检,对前列腺增生和前列腺特异抗原(PSA)升高的患者进行监测。这些对前列腺增生的研究中,本品未改变前列腺癌的检测率,并且使用本品与使用安慰剂的患者前列腺癌的总发病率没有显着差异。
建议在接受本品治疗前及治疗一段时间之后定期做直肠指诊,以及其它的前列腺癌检查。血清PSA也用于前列腺癌的检查。一般来说,基线PSA>10纳克/毫升(Hybritech)则提示应进一步检查并考虑活检;PSA水平在4和10纳克/毫升之间建议作进一步检查。在患有或未患有前列腺癌的男性中PSA水平存在一定的重叠。因此,患前列腺增生的男性,不管是否服用本品,若PSA值在正常参考范围内并不能排除前列腺癌的可能性。若基线PSA
即使伴有前列腺癌,本品可使前列腺增生患者血清PSA浓度大约降低50%。在评价PSA数据且不排除伴有前列腺癌时,应考虑本品会使前列腺增生患者的血清PSA水平降低。虽然患者有个体差异,在PSA数值范畴数据,其降低程度是可预测的。对来自3000多名患者的双盲、安慰剂对照的4年期本品长期疗效和安全性研究(PLESS)的PSA数据的分析证明,典型患者使用本品治疗6个月或更长,与未经治疗的男性正常PSA值比较,其PSA值应该加倍。这种调整不但保留了PSA检测的灵敏性和特异性,而且保持它检查前列腺癌的效能。
应谨慎评价使用非那雄胺治疗的患者的PSA水平持续增高,包括考虑本品治疗的非依从性。
本品不会引起游离PSA百分比(游离PSA/总PSA)的显着下降,而且在本品的影响下游离PSA/总PSA值保持恒定。当游离PSA百分比用于检测前列腺癌时,其值无需调整。
药物/实验室检查相互作用
对PSA水平的影响
血清PSA浓度与患者年龄和前列腺体积有关,而前列腺体积又与患者年龄有关。当评价PSA实验室测定结果时,应考虑接受本品治疗的患者PSA水平降低的事实。大多数患者,在治疗的第一个月内PSA迅速降低,随后PSA水平稳定在一个新的基线上。治疗后基线值约为治疗前基线值的一半。因此,用本品治疗六个月或更长的典型患者,在与未经治疗男性的正常PSA值相比较时PSA值应该加倍。临床解释见注意事项
 爱华网
爱华网