抗原表位_表位 -定义
表位(epitope)又叫抗原决定基(antigenicdeterminant),指被抗原受体TCR和BCR特异性识别的抗原部分。一般来说,只有位于抗
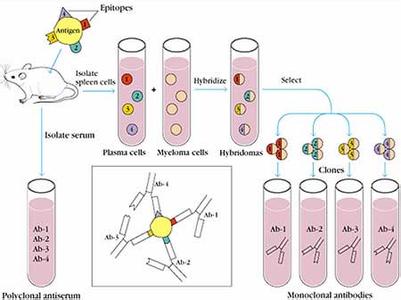
抗原表位原物质表面的表位易与抗原识别受体或抗体结合,称功能性表位。而位于分子内部的表位无免疫原性,称隐藏性表位。表位的结构有两类,即构象表位和线性表位。抗原决定基(antigenicdeterminant)是存在于抗原分子表面决定抗原特异性的特殊化学基团,又称表位(epitope)。抗原分子的决定基大小不同,可由数个氨基酸或糖基组成,最小的抗原只含有4~6个氨基酸残基或糖基。不同氨基酸残基排列不同,有的呈线性或连续性排列,有的呈折叠状肽链。其中有很多决定基被掩盖在内部称隐性决定基(无功能决定基);决定基被免疫细胞识别,启动免疫应答或与抗体结合,这种决定基称为功能性决定基。对于血清免疫检验学来说,了解决定基的数量是很重要的。Seal提出一个估计的方法,即每5000dalton就有一个决定基。[道尔顿dalton一道尔顿相当于1.661×10-24(=Avogadro数之倒数)g,一个分子的质量,用道尔顿单位表示时,其值相当于分子量]
抗原表位_表位 -抗原表位
抗原表位(英语:antigenicepitope),简称“表位”,也称为“抗原决定簇”(antigenicdeterminant),是指抗原表面上决定抗原特异性的化学基团。抗原表位可被免疫系统(尤其是抗体、B细胞或者T细胞)所识别。抗体中能识别抗原表位的区域叫做“互补位”或“抗体决定簇”。尽管通常抗原表位是指外来蛋白质等物质的其中一部分,但只要能被自身免疫系统所识别的表位,也被归为抗原表位。蛋白质抗原的表位根据它们的结构以及与互补位的交互作用,被分为构象表位和线性表位这两种类型[1]。其中构象表位有抗原氨基酸序列中的不连续部分组成,因此互补位和抗原表位的交互作用是基于表面的三位特征和形状,或者是抗原的三级结构。大部分的抗原表位都属于构象表位。与此相反,线性表位是由一段连续的抗原氨基酸序列构成,与抗原的交互作用的基础是其一级结构。
功能
T细胞表位
T细胞抗原表位出现在抗原呈现细胞上,这种抗原将会和主要组织相容性复合体(MHC)相结合。由I型主要组织相容性复合体所呈现的T细胞抗原表位通常是由8至11个氨基酸长度的多肽,而II型主要组织相容性复合体所呈现的T细胞抗原表位相对更长,由13-17个氨基酸组成[2],而非经典组要组织相容性复合体则呈现非多肽类的抗原表位,
抗原表位例如糖脂。
交叉反应
抗原表位有时候会发生交叉反应,这一特点通过抗独特型抗体的调控,被免疫系统所利用。这一理论最初是由诺贝尔奖获得者尼尔斯・杰尼所提出的。如果抗体和某个抗原的表位结合,这一互补区会变成抗原表位被另一个抗体所捕获。如果第二个抗体是一个IgM类型的抗体,则这一结合会提升免疫系统的响应;而如果第二个抗体是IgG类型的抗体,则这一结合会降低免疫系统的响应。
抗原表位的绘制
主条目:抗原表位作图
抗原表位可以通过蛋白质阵列文库等技术进行绘制。同时,目前正在大力开发一些可靠的工具,用于预测蛋白质的抗原表位。
抗原标记
抗原表位通常会被用于蛋白质组学以及其它基因产品的研究当中。通过DNA重组技术,能够被普通抗体所识别的编码抗原表位的基因序列,可以被融合到某段基因当中。其后该表位被合成为蛋白质或者其它基因产品的一部分,上面的抗原表位标记会被抗体或者其它基因产品,使得定位、提纯以及进一步的分子鉴定等实验室技术变得可行。用于该目的的抗原表位通常为Myc标记、HA标记、FLAG标记、GST标记、6xHis标记[3]以及OLLAS标记[4]。
 爱华网
爱华网