电偶腐蚀(galvanic corrosion)是与伽伐尼电池的电流相关联的腐蚀,称为“伽伐尼腐蚀”,伽伐尼电池可由处于同一电解质中的两种不同的导体所组成,也可由分别处于两种电解质中的两个相同的导体所组成。
电偶_电偶腐蚀 -简介
由于腐蚀电位不同,造成同一介质中异种金属接触处的局部腐蚀,就是电偶腐蚀(galvanic corrosion),亦称接触腐蚀或双金属腐蚀。该两种金属构成宏电池,产生电偶电流,使电位较低的金属(阳极)溶解速度增加,电位较高的金属(阴极)溶解速度减小。所以,阴极是受到阳极保护的。阴阳极面积比增大,介质电导率减小,都使阳极腐蚀加重。防止方法:避免异种金属接触;结构上避免大阴极对小阳极;设计易更换阳极部件的结构;两种不同金属接触面间采用电绝缘。
两种或两种以上不同电极电位的金属处于腐蚀介质内相互接触而引起的电化学腐蚀,又称接触腐蚀或双金属腐蚀。电偶腐蚀原理见图1。发生电偶腐蚀时,电极电位较负的金属通常会加速腐蚀,而电极电位较正的金属的腐蚀则会减慢(见金属腐蚀)。
电偶腐蚀合金中呈现不同电极电位的金属相、化合物、组分元素的贫化或富集区,以及氧化膜等也都可能与金属间发生电偶现象,钝化与浓差效应也会形成电偶型的腐蚀现象,这些微区中的电偶现象通常称为腐蚀微电池,不称作电偶腐蚀。
电偶_电偶腐蚀 -电偶腐蚀形成的原因
点位之间的电位差
点位较正的“不锈钢管”和点位较负的“碳钢管”偶接,“不锈钢管”呈阴极,“碳钢管”呈阳极,二者的电位差越大则电偶腐蚀倾向愈大。形成电子通道
经导线连接或直接接触后形成电子通道。“碳钢管”中的铁失去的电子到达“不锈钢管”表面被腐蚀剂吸收。(内衬不锈钢复合钢管,没有电解质成为离子通道"面积")
金属之间接触区有电解质覆盖或浸没
两种金属的接触区有电解质覆盖或浸没。“碳钢管”中的铁失去的电子形成离子进去溶液,“不锈钢管”表面的电子被电解质中的腐蚀剂(如空气中的氧) 拿走。电解质成为离子通道(内衬不锈钢复合钢管,没有铁失去的电子形成离子进去溶液)。
只有改变三个条件中的一个,双金属腐蚀既被终止 电偶腐蚀与双金属接触面积有关,接触面积愈大。腐蚀愈小。电偶腐蚀的驱动力是电位差。
内衬不锈钢复合钢管是通过冷滚压复合技术,将内管为不锈钢,外管镀锌钢管复合而成。他分成:
(1) 适量复合:复合界面接合距离用电子显微镜测量大于25μ,复合强度为大于0.2 MPa;
(2) 过盈复合:复合界面接合距离用电子显微镜测量5~25μ,复合强度为 2~4Mpa;
(3) 过量复合:复合界面接合距离用电子显微镜测量小于5μ,复合强度为大于 4Mpa。
复合器向外滚压使外管发生弹性变形,内管发生塑性变形,二者产生过盈配合,紧密贴合。该复合技术的优点是:结合强度、致密性高,成型率高,能耗低,速度快,代表了当今机械复合技术的水平。
内衬不锈钢复合钢管,没有电解质成为离子通道;没有铁失去的电子形成离子进去溶液;只有两金属电位差。因此,没有形成电偶腐蚀。
电偶_电偶腐蚀 -判断
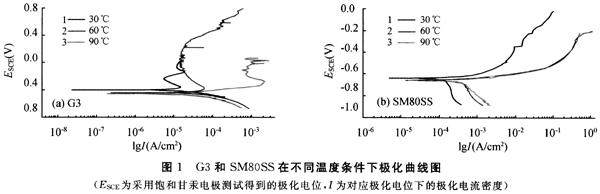
根据电化学理论可以对电偶腐蚀现象作定性判断,但对腐蚀的结果还难以作出动力学分析。各种常见的金属或合金在某些腐蚀介质内的标准电极电位虽已充分了解,但还不能由此确定电偶腐蚀的速度及其结果的实际图像,也就是还不能从电偶中不同金属的可逆电极电位之差直接得到各部位电偶腐蚀速度的定量关系。在工程设计中,往往需要结合在实际介质中的腐蚀电位和可能掌握的极化曲线特征作出判断,并作必要的实际测定和验证。在腐蚀过程中,随着条件的变化,金属的电偶序有可能发生变化,甚至出现极性倒转。此外,电偶腐蚀的结果也直接与电极的面积大小有关。影响电偶腐蚀速度的因素主要有:①所形成的电偶间的电极电位差;②腐蚀介质的电导(图2);③金属表面的极化和由于阴、阳极反应生成表面膜或腐蚀产物的影响;④电偶间的空间布置(几何因素)。电偶腐蚀速度,在数量上服从法拉第电解定律。两金属之间的电极电位差愈大、电流愈大,则腐蚀愈快。电路中的各种电阻则按欧姆定律影响电偶腐蚀电流,介质的电导率高,则加速电偶腐蚀 (见水溶液电解、电势-pH图)。
电偶腐蚀,电偶作用有时也会促进阴极的破坏,如等面积的铝(阴极)和镁(阳极)在海水中,电偶作用将加速镁阳极的腐蚀,而在充气条件下阴极表面上的主要产物OH-也会同时促进铝的破坏,所以电偶中的两极最终都会加剧腐蚀。
电偶_电偶腐蚀 -防止措施
电偶腐蚀的主要防止措施有:①选择在工作环境下电极电位尽量接近(最好不超过50毫伏)的金属作为相接触的电偶对;②减小较正电极电位金属的面积,尽量使电极电位较负的金属表面积增大;③尽量使相接触的金属电绝缘,并使介质电阻增大;④充分利用防护层,或设法外加保护电位。选择防护方法时应考虑面积律的影响,以及腐蚀产物的影响等。
 爱华网
爱华网