氟是一种非金属化学元素,化学符号F,原子序数9。氟是卤族元素之一,属周期系ⅦA族,在元素周期表中位于第二周期。氟元素的单质是F2,它是一种淡黄,剧毒的气体。氟气的腐蚀性很强,化学性质极为活泼,是氧化性最强的物质之一,甚至可以和部分惰性气体在一定条件下反应。氟是特种塑料、橡胶和冷冻机(氟氯烷)中的关键元素。由于氟的特殊化学性质,氟化学在化学发展史上有重要的地位。
氟_氟 -简介
氟原子结构
氟是一种具有极强腐蚀性的淡黄色双原子气体,是自然界电负性最强的元素,也是最强的单质氧化剂。
名称由来
氟,安德烈・玛丽・安培将之命名为Fluorine,该词来自拉丁文fluere(帮助熔融的物质),也就是氟化钙(萤石)的最初用途;之后安培改称为phthorine(破坏的),该词来自希腊文;但是绝大部分语言多半已固定使用修改自Fluorine的名词,因此此一名称只有希腊至21世纪仍在使用。
日文音译德文Fluor的第一个发音而称之为“弗素”,韩文过去也使用该词,但现代多半以谚文拼写为“????”。
氟_氟 -发现
氟原子
早在16世纪前半叶,氟的天然化合物萤石(CaF2)就被记述于欧洲矿物学家的著作中,当时这种矿石被用作熔剂,把它添加在熔炼的矿石中,以降低熔点。因此氟的拉丁名称fluorum从fluo(流动)而来。它的元素符号由此定为F。
1771年瑞典化学家舍勒制得氢氟酸。此后的一百多年中,戴维盖・吕萨克、诺克斯兄弟等很多人为制取单质氟而中毒,鲁耶特、尼克雷因中毒太深而献出了自己的生命。
拉瓦锡在1789年的化学元素表中将氢氟酸基当作是一种元素。到1810年戴维确定了氯气是一种元素。
1812年,法国科学家安培根据氢氟酸和盐酸的相似性质和相似组成,大胆推断氢氟酸中存在一种新元素。他并建议参照氯的命名给这种元素命名为fluorine。但单质状态的氟却迟迟未能制得。
1886年6月26日,法国化学家弗雷米的学生亨利・莫瓦桑制得单质状态的氟,莫瓦桑因此获得1906年诺贝尔化学奖。
氟_氟 -性质
物理性质
氟在标准状态下是淡黄色气体,液化时为黄色液体。在-252℃时变为无色液体。由于氟的特殊化学性质,导致其物理性质的测定的难度较大,一些数据的准确性并不是很高,下面的数据采用了参考资料中的最新数据或时间相近数据中有效数字位数较多者。
原子半径:71pm(F-F),64pm(F-C);
离子半径:133pm;
密度:1.696g/L(273.15K,0℃);
熔点:-219.66℃ ;
熔化热:510.36±2.1J・mol-1;
沸点:-188.12℃[1];
气化热:6543.69±12.55J・mol-1(84.71K,9.81kPa);
蒸气压(l)(kPa):
蒸汽压(l)(kPa)
蒸气压(s)(kPa)T(K)53.5660.5069.5777.1781.5985.0589.40P(kPa)0.2231.71911.2437.3867.21101.7162.64
溶解度:与水反应 ;
临界温度:144K;
临界压力:55atm;
热导率:W/(m・K)27.7
化学性质
电子层排布:[He]2s22p5 ;主氧化态:F(-I),F(0) ;
电负性:3.98(鲍林标度) ,4.10(阿莱-罗周标度),3.91(马利肯标度);
晶体结构:简单立方;晶胞参数:a=550pm,b=328pm,c=728pm,α=β=γ=90°;
化学键能(kJ/mol):F-F:159;F-H:569;F-O:190;F-N:272;F-C:456;F-B:644 ;F-Al:582;
亲和能:328.16kJ・mol-1;
电离能(kJ/mol):I1:1681.0;I2:3374;I3:6050;I4:8408;I5:11023;I6:15164;I7:17867;I8:92036;:I9:106432;
单质解离能:157.7kJ・mol-1;
F-水和能:-506.3kJ・mol-1;
标准熵:F:158.6J・mol-1・K-1,F2:202.5J・mol-1・K-1;
标准电极电势:E?(F?/HF)=3.053V,E(F?/F-)=2.87V。
氟是已知元素中非金属性最强的元素,这使得其没有正氧化态。氟的基态原子价电子层结构为2s22p5,且氟具有极小的原子半径,因此具有强烈的得电子倾向,具有强的氧化性,是已知的最强的氧化剂之一。
氟的卤素互化物有ClF、ClF3、BrF3、IF6等。
活性
在常温下,能同绝大多数元素单质发生化合反应,并剧烈放热。和氢气即使在-250摄氏度的黑暗中混合也能发生爆炸,故液氟和液氢也用作高能火箭的液体燃料。由于氟的电负性在所有除氖外的元素中最强(阿伦标度),而目前(2012)还没有制得氖的化合物,因此在所有的化合物中,氟都显-1氧化态,一化合价。在少量氟气通过冰面时反应生成不稳定的次氟酸(HFO),其中的F仍为-1氧化态。
由于氟的高度活性,稀有气体的化合物也是最早从氟或含氟化合物开始制备的。最早得到的是六氟合铂酸氙(XePtF6),此后还得到XeF2、XeF6、XeO3以及氪的氟化物等。此外,氟单质也用于获得一些高价的过渡金属化合物,比如Cs2CuF6、AuF5、UF6等。
惰性
氟
链烷基上的氢可以完全或部分被氟取代。完全被氟取代的化合物通常称为“全氟代物”。与碳氢化合物不同,由于氟原子半径略大于氢原子,所以全氟碳链上的氟原子排列略呈螺旋状。这一类化合物具有与众不同的惰性。
不粘性
一般全氟的高分子非常稳定,耐热耐寒、抗腐蚀性强。如聚四氟乙烯(Teflon),可以耐高达260摄氏度的温度,不沾水和一般有机溶剂。故被用于制作不粘锅,以及一些化学反应容器。
溶解性
只有氟单质、三氟化氯、五氟化氯和熔融碱金属可以在高温下腐蚀聚四氟乙烯。全氟代有机物在室温下与一般溶剂难以互溶(醚、酯等除外),而加热后,溶解度有所增加。这类全氟代有机物用作溶剂时,在溶液中和有机溶剂、水分成单独的一个相,一般称作“氟碳相”。随着氟链的增长或者增多,全氟代有机物在有机溶剂和全氟溶剂中的溶解度都会显著下降。QSAR的计算表明,有机分子中,如果氟原子的质量比重超过60%,就可以呈现出“全氟”的特性。
腐蚀性
氟及其一些化合物都有毒和较强的腐蚀性。氢氟酸可以腐蚀玻璃。而氟离子在人体组织内有渗透性。氢氟酸接触皮肤如不及时处理可以腐烂至骨而造成永久性的损伤,而氟离子可以和钙离子结合而使人发生中毒。而且氢氟酸的灼伤不易被发觉,一般是麻痹1-2小时后才有疼痛感。一旦接触氢氟酸,应该立即用大量水冲洗,并涂上20%氧化镁的甘油悬浮液。而FSO3H、SbF5等化合物具有远强于硫酸等一般强酸的酸性,特定比例的混合物甚至可以分解石蜡。
特殊性质
氟卤族元素具有一些相似的性质,但是由于F的原子半径特殊的小,使得F有一些特殊的性质。
1.主要氧化数:F无正氧化数
2.解离能:F-F<Cl-Cl
3.分解水:F2氧化H2O
4.第一电子亲合能:F<Cl>Br>I
5.卤化物热力学稳定性:氟化物最稳定
6.卤化物配位数(C.N.):氟化物最大AsF3AsCl3AsBr3AsI3AsF5AsCl5(-50℃分解)PbF4PbCl4(R.T.分解)
F的一些特殊性质可以从以下几个方面进行解释:
1.F的电负性最大;
2.标准电极电势F2/F-最大;
3.F的原子半径r最小;形成共价键化合物p∏-p∏或p∏-d∏存在,F-F键能较小,
4.热力学离子型卤化物:氟化物晶格能U最大。
5.共价型卤化物:氟化物ΔfGmO最负。ΔrHm=S+1/2D+I+(-E)+(-U)F的解离能低,NaF晶格能力最大,生成焓更负,热力学稳定性强。
注:氟化氢(氢氟酸)是唯一可使二氧化硅溶解的酸,生成易溶于水的氟硅酸
氟_氟 -制取单质氟
实验室中用化学方法制备单质氟是1986年KarlChriste报导的。以HF、KF、SbCl5和KMnO4为原料,首先分别制备出K2MnF6和SbF5,再以K2MnF6和SbF5为原料制备MnF4,MnF4不稳定,可分解放出F2:
2KMnO4+2KF+10HF+3H2O2――〉2K2MnF6+8H2O+3O2
K2MnF6+2SbF5――〉2kSbF6+MnF4(在423K)
2MnF4――〉2MnF3+F2
不过该方法并无工业价值,只是证实了纯化学方法制备单质氟的可行性。
氟_氟 -用途
氟
1、制造含氟高分子材料(如聚四氟乙烯塑料、含氟质子交换膜如杜邦Nafion膜等)。
2、含氟农药。
由于有机分子中的氟原子和三氟甲基等有强的亲酯性,故在农药分子中引入氟原子可以显著降低其用量。
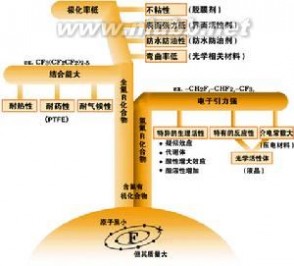
3、氟碳相的应用。
利用氟碳相在高温与有机相互溶、低温下则不互溶的性质,可以用于萃取有机相中的含氟化合物。也可以由此特性使用亲氟或含氟的催化剂,在反应过程中使包含催化剂的氟碳相和有机相互溶,而反应完成后则降温,使大部分催化剂仍然留在氟碳相中,从而节约催化剂的用量。
氟
4、商家在牙膏中加入含氟化合物,可以有效防止蛀牙。
5、氯氟碳化合物(氟氯代烷)(俗称氟里昂Freon)或者溴氟碳化合物等。被用作灭火剂和空调制冷剂。
需要指出的是,导致臭氧层分解的是氟里昂因光解产生的氯自由基,而非氟原子。所以现在一些绿色冰箱制造商所打的“不含氟”口号容易造成“氟元素破坏臭氧层”的误解。其中的“氟”应为含氯的“氟里昂”。
6、六氟化铀(UF6),用于使用气体扩散法分离同位素U-235和U-238。和Pu-239一样,前者可以用于制造核弹。
当一定形状的U-235超过临界质量后,中子可以引发其链式反应而瞬间释放巨大能量。后者U-238则只能用于增殖弹。气体扩散法利用六氟化铀-235和六氟化铀-238分子质量的微小差异,通过扩散来富集前者。由于扩散速率和分子量的平方根成反比,所以这个方法需要庞大且耐腐蚀(六氟化铀易水解释放出有毒且腐蚀性的UO2F2和HF)的设备,因而代价高昂。二战时美国的“曼哈顿工程”就是通过这个方法浓缩到足够制造核弹的U-235的。
7、人造血液。
一些全氟醚类化合物可以携带氧气和部分人体需要的养料和排泄物等。在需要全身换血时,可以用它暂时代替病人体内的血液;由于其挥发性,待几天后可自行排出。因为全氟化合物很稳定,一般很少有毒副作用。
氟_氟 -危害
腐蚀性
氟骨症
氟及其一些化合物都有毒和较强的腐蚀性。
氢氟酸可以腐蚀玻璃,接触皮肤如不及时处理可以腐烂至骨而造成永久性的损伤。氢氟酸的灼伤不易被发觉,一般是麻痹1-2小时后才有疼痛感。一旦接触氢氟酸,应该立即用大量水冲洗,并涂上20%氧化镁的甘油悬浮液。而FSO3H、SbF5等化合物具有远强于硫酸等一般强酸的酸性,特定比例的混合物甚至可以分解石蜡。
氟离子在人体组织内有渗透性。可以和钙离子结合而使人发生中毒。
中毒表现
氟中毒主要表现为氟骨症和氟斑牙。长期摄入低剂量的氟所引起的不良反应为氟斑牙,而长期摄入高剂量的氟则可引起氟骨症。早中期表现如:
1、氟斑牙:牙齿畸形、软化、牙釉质失去光泽、变黄;
2、氟骨症:骨骼变厚变软、骨质疏松、容易骨折。
氟中毒晚期往往有慢性咳嗽、腰背及下肢疼痛、骨质硬化、肌腱、韧带钙化和关节囊肥厚、骨质增生、关节变形等。另外,机体代谢过程中所需要的某些酵素系统会被破坏,导致多器官病变。
氟_氟 -储存
一般单质氟气以特制铜镍合金钢瓶贮存。
在有机化学中使用氟气可以直接氟化羰基、羟基等官能团,其中使用的是掺有5%或10%氟的干燥氮气。
氟_氟 -氟的分布
自然界
氟是自然界中广泛分布的元素之一,在卤素中,它在地壳中的含量仅次于氯。重要的矿物有萤石、氟磷酸钙等。氟的天然同位素只有氟19。
氟鱼类是首选的来源,饮用水和食盐中有一定含量,但有地区性差异。食品中按每100克所含微克计算:黑茶叶为8500,胡桃类为680,豌豆类155,谷类50~150,蔬菜10~110,鲜鱼580,海鱼140-370,猪肝290,牛肝130,蛋类HO,肉类20-100,牛奶(浓缩)45。
人体分布
人体需要量主要来自食物。一般情况下,动物性食品中氟高于植物性食品,海洋动物中氟高于淡水及陆地食品,鱼和茶叶氟含量很高。
氟元素在正常成年人体中约含2克-3克,人体含氟约2.6g,主要分布在骨骼、指甲、毛发中。人体每日摄入量4mg以上会造成中毒,损害健康。
90%左右的氟积存于骨骸及牙齿中,血液中每毫升含有0.04微克-0.4微克。从膳食中摄取的氟50%-80%可被吸收,饮水中的氟可完全被吸收,因此水是机体摄取氟的主要来源。
摄入
成年人适宜摄入量为1.5mg/天,最高可耐受摄入量为3.0mg/天。
氟化物经消化道和呼吸道吸收入血。血内的氟分离子理和非离子型。非离子型氟与血浆蛋白结合,离子型的氟才具有生理作用。两者保持着动态平衡。氟溶于水,非常容易被吸收,血中的氟随着循环分布到全身各个组织器官。吸收量可达其中的80%。氟对骨骼和牙齿的亲和力很强,其中的90%以上沉积在骨骼和牙齿中。骨骼甚至可称为人体的"氟库",可以容纳大量的氟。体内氟含量,按离子计算,约含2,6克。超过此量时可使机体内的氟“超负荷”。
氟_氟 -制备方法
与氟处于同一族的氯通常使用电解法氯化钠法制取,然而,由于氟离子的还原性极弱,使得氟单质不能通过电解氟化物水溶液的方式获得。
工业上使用电解液态氟化氢的方法制取氟单质,其基本原理是:2HF=H2+F2,由于无水氟化氢导电性能不佳,会将其中加入氟化钾以增强其导电性,并在电解过程中不断加入HF以保持其液态
实验室通常利用一些不稳定的氟化物来制取氟单质:例如六氟合铅酸钠是一种不稳定、易分解的氟化物,加热生成四氟合铅酸钠和氟气。此外四氟化锰在热力学上也不稳定,但其盐[MnF6]能稳定存在,于是用强路易斯酸五氟化锑将其从[MnF6]中取代出来,便得到氟单质
方程式 1
方程式 2
氟_氟 -氟化合物的安全
氟化合物对人体有害,少量的氟(150mg以内)就能引发一系列的病痛,大量氟化物进入体内会引起急性中毒。因吸入量不同,可以产生各种病症,例如厌食、恶心、腹痛、胃溃疡、抽筋出血甚至死亡。若中毒量不足致死,人体可以迅速从氟中毒中恢复,尤其在使用静脉注射或是肌肉注射葡萄糖酸钙治疗时,约有90%的氟可被迅速消除,剩余的氟则需要时间除去。经常接触氟化物,容易导致骨骼变硬、脆化,牙齿脆裂断落等症状,部分地区饮水中含氟量过大也容易导致氟中毒。
痕量的氟有利于预防龋齿,若水中的氟含量小于0.5ppm,龋齿的病发率会达到70%~90%。但如果饮用水中含氟量超过1ppm,牙齿则会逐渐产生斑点并变脆。饮用水中氟含量超过4ppm时,人易患氟骨病,导致骨髓畸形。降低饮用水中氟含量的方法是煮沸饮用水。
不溶性的氟化物毒性低,对皮肤无刺激,但若吸入大量粉尘,则容易被人体吸收而慢性中毒。可溶性的氟化物被吸收后可迅速排出,一次吞服5~10g则会引起胃肠出血而死亡。酸性氟化物,例如氢氟酸,氟硼酸等会剧烈腐蚀皮肤,接触处会发生红肿并蔓延,产生难以愈合的溃疡。单质氟、氟化氢等气体对人眼、鼻有刺激,吸入量过大则会引起严重的气管炎和肺水肿,导致死亡。
接触氟化物工作的人最严重和最危险的是脸部和皮肤接触氟和氟化物。因此在使用氟和氟化物时必须遵守操作流程,并有可靠的安全措施,包括操作用具、橡皮手套,有遮盖的防护面罩和有防酸性气体的防毒面具。工作场所应有良好的通风设施,对于反应活性大的物品应有防爆装置。被氟化氢与其他氟化物灼伤时要及时处理灼伤部位先用大量水冲洗,再用甘油氧化镁涂敷,最妥善的方法是立即在患处注射葡萄糖酸钙,使氟被固定为不溶性的氟化物。此外使用六氟灵冲洗是处理氢氟酸事故的良好方法,六氟灵的原理是通过中和反应和配位作用减少人体内的氢离子与氟离子数量。
一部分有机氟化物的毒性很大,其中对于含氟羧酸,结构通式为F(CH2)nCOOH,若n为奇数则该有机物是极毒的,n为偶数时毒性很小甚至无毒。 在2013年11月底发生过快递运送氟乙酸甲酯而致人死亡的事件,其中氟乙酸甲酯的氟乙酸部分n=1。
氟对于昆虫的毒性近似于氟化氢,对于植物的毒性则近似二氧化硫,氟化合物会使得植物叶端和叶脉出现白斑或者褐斑。
 爱华网
爱华网