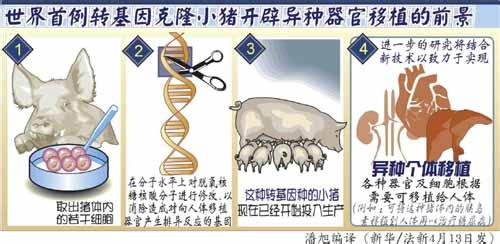
异种器官移植,是用手术的方法将某一种属个体的器官或组织移植到另一种属个体的某一部位。科学家在动物身体上培育出新的器官,这些器官复盖在人类干细胞培育环境中,发育的新器官可被人类身体所接受,只要人体接受这些“异种器官移植”不引起悲惨性的免疫系统反应,这将形成事实上源源不断的人体移植器官来源,从而有效解决人体移植器官严重短缺的现状。但同时,异种器官移植培养出的器官移植于人体,会存在跨物种病毒感染的隐患等问题。
异种器官移植_异种器官移植 -研究进展
1920年,俄国医生甫洛诺夫(Serge Voronoff)为了给病人注入青春的活力,将黑猩猩的睾丸切片植入老年男子的阴囊内,10年后,已有数百人接受了这样的手术,女性也接受猩猩卵巢组织移植以治疗更年期症状
2009年成果
异种器官移植
2009年国明尼苏达州立大学干细胞科学家桃瑞丝-泰勒(Doris Taylor),在实验室中实现了为新培育的微型心脏连接人造血液供给,人造心脏能够像正常老鼠体内的心脏一样跳动,但这种心脏看上去更加与众不同:它复盖着一层老鼠心脏去细胞组织的“脚手架”,而且新培育的老鼠心脏组织是基于另一只老鼠的干细胞培育而成。
桃瑞丝的方法非常简单:从人体捐献者或其他动物身体上提取器官,然后用温性洗涤剂去除器官上的肌肉、细胞和DNA,只保留一种叫做“免疫惰性”蛋白质的内部“脚手架”蛋白质,从相关患者体内提取干细胞附加在这个“裸体脚手架”上,来自患者体内的干细胞在培育过程中,会对移植器官起到主体免疫功能,并避免主体遭受由于移植器官导致的新感染。
培育出简单的器官
基于桃瑞丝的方法已成功培育出一些简单的器官,2008年,患者克劳迪娅-卡斯蒂诺(Claudia Castillo)接受了一个来自死亡捐献者的气管移植器官,研究人员从捐献者体内提取气管,进行大小剪裁,然后放入从克劳迪娅体内提取的干细胞培养环境脚手架中,最终发育形成相应的气管组织。
她还基于这项老鼠实验,重复性地试着培育猪的心脏和肝脏,对于猪器官的培育将更简单一些,因为猪的体型更大,要比处理培育体型较小的老鼠器官更容易。预计去细胞化的移植肝脏器官将比心脏更早地培育出来。
其他研究小组也从事于移植肝脏培育研究,科学家史蒂文-巴迪拉克(Steven Badylak)称,现已研究出如何在老鼠体内培育肝脏去细胞培育法,只是该技术尚未发布。此外,美国马萨诸塞州总医院的研究小组负责人马丁-亚穆什(Martin Yarmush)培育了人造可移植老鼠肝脏器官,从而证明在实验室内可以培育出具备肝功能的移植器官。据该研究小组成员科库特-尤冈(Korkut Uygun)称,研究小组的最终目标是培育出人体去细胞移植器官,并不仅是简单的动物器官。
技术难点
桃瑞丝这种培育的复杂器官面临的较大挑战是如何确保所有的器官内细胞与患者的血液相溶合,如果没有血液进入,移植器官中心的细胞则会严重缺氧,导致移植后细胞死亡。桃瑞丝称,她有办法能够克服这种困难。2008年1月,她带领的一支研究小组实现了较大的技术突破,他们基于新生老鼠心脏细胞培育出一个跳动中的心脏,这个心脏保持着3D外形,其内部充满着所有血管。当他们植入一些新的细胞,会生长出血管组织。此外,桃瑞丝表示他们几乎能够重新培育出带有细胞的完整血管系统,其中包括动脉、静脉和毛细血管。她说:“由于我们培育出了血管,新的移植器官能够与患者身体的血液供给系统自然地连接在一起。”在移植心脏器官的培育过程中,干细胞转换成为心室和心房的内皮细胞,还可形成血管和心脏平滑肌细胞。
匹兹堡大学医学院的大卫-库珀(David Cooper)是异种器官移植技术的主要研发人员,他指出,“裸体”猪心脏仍携带着alpha-Gal抗原体,人体免疫系统能够识别,并遭受其攻击。但是伦敦大学学院再生医学教授克莉丝-梅森(Chris Mason)指出,许多培育的去细胞猪器官都没有施用辅助免疫药物,必须对猪器官内对人体免疫系统构成攻击的物质彻底消除,否则未来数百万名患者一旦接受猪心脏移植后将出现心脏瓣膜和相关组织的副作用。
排异反应
猪心脏经过去细胞化处理后,现成为培育人类移植心脏“脚手架”
异种器官移植
动物器官异种移植排异过程在某些方面与同种排斥相似,可以借鉴。但异种移植又有其特性:细胞表面存在更多的“异物”,会与宿主产生强烈的反应,这种跨物种间的移植存在较大的分子差
异,包括天然抗体、补体、NK细胞和巨噬细胞等。常出现的超急性排异反应(HAR),排异反应在血液循环后几分钟或数小时发生,也可在24-48小时内发生不可逆转体液排斥反应,较常见的发生在手术台上;急性血管性排斥反应(AVR),血管化脏器移植后数天到数周间发生,也是不可逆转性体液排斥反应,常发生在手术后早期,病情进展迅速;加速性细胞排斥反应(TMR),受者循环血液中存在抗供者抗体并不一定引起HAR和AVR的情况下,可能出现加速性细胞排斥反应。该反应对免疫抑制剂抑制效果不良。受者抗供者抗体的存在可促进抗体依赖性细胞介导的细胞毒作用,促使发生细胞性排斥反应,病理表现以间质水肿和局限性炎性细胞浸润为特征,细胞浸润的局部毛细血管内皮细胞变性和坏死。异种移植的免疫障碍也远远大于同种移植(Allografts)。
异种器官移植排斥反应类型
依据供、受者种族遗传背景差异程度分为协调性(Concordant)和非协调性(Discordant)。协调性异种移植发生在种属较近的动物之间,如大鼠与小鼠之间;非协调性异种移植则在种系发生较远的种属间进行,排斥以分钟或小时计,常导致HAR发生,如猪器官移植到人、豚鼠与大鼠之间的移植。有学者将协调性异种移植分为困难型和容易型;依据排斥反应发生机理将非协调性异种移植分为抗体型和非抗体型两类。所不同的是在协调性异种移植中是诱生抗体,而在非协调性移植中则是预存天然抗体。
存在问题
异种器官移植
虽然异种器官移植给人类移植器官的短缺带来希望,但有些科学实验表明还有令人担心的问题存在。美国加州斯克里普斯研究所丹尼尔・沙罗门等人在实验中发现,猪体内普遍存在的“猪内生逆转录酶病毒”能感染人体细胞。沙罗门等还发现,将猪胰腺细胞移植给免疫功能受到抑制的实验鼠后,该病
毒会被激活,使鼠机体多种组织受到感染。
科学家尚未发现该病毒对猪有害,受感染的实验鼠也未患上疾病。但是,人体被该病毒感染后会产生什么后果,目前还不得而知。不同动物体内有不同的微生物群,对一种动物无害的病毒,在另一种动物身上可能造成严重危害,这并非没有先例。1997年,英国伦敦大学学院的罗宾・韦斯等就曾报告说,他们在猪体内发现了两种新型病毒。这两种病毒不仅不损害猪的健康,而且一定程度上还能增强猪的机体功能。然而它们却能使猴子、猫和某些鸟类患上白血病。从其结构推断,科学家认为它们也可能会让人类患上白血病。
科学家担心,人类对猪体内的各种病毒还了解得太少,将猪器官移植给人存在风险,甚至有可能引发新型大规模传染病,产生不堪设想的后果。
尽管病毒问题给异种器官移植的前景投下重重阴影,许多科学家仍赞成继续这类研究。他们指出,异种器官移植具有极大医疗潜力,不应半途而废。科学家们呼吁深入研究猪体内的病毒并寻求相应的对付方法,同时对移植试验进行严格的审查与控制。
异种器官移植_异种器官移植 -器官移植排斥的类型
宿主抗移植物反应
异种器官移植
受者对供者组织器官产生的排斥反应称为宿主抗移植物反应(host versus graft reaction,HVGR)根据移植物与宿主的组织相容程度,以及受者的免疫状态,移植排斥反应主要表现为三种不同的类型。
(一)超急排斥
超急排斥(hyperacute rejection)反应一般在移植后24小时发生。目前认为,此种排斥主要由于ABO血型抗体或抗Ⅰ类主要组织相容性抗原的抗体引起的。受者反复多次接受输血,妊娠或既往曾做过某种同种移植,其体内就有可能存在这类抗体。在肾移植中,这种抗体可结合到移植肾的血管内皮细胞上,通过激活补体有直接破坏靶细胞,或通过补体活化过程中产生的多种补体裂解片段,导致血小板聚集,中性粒细胞浸润并使凝血系统激活,最终导致严重的局部缺血及移植物坏死。超急排斥一旦发生,无有效方法治疗,终将导致移植失败。因此,通过移植前ABO及HLa 配型可筛除不合适的器官供体,以预防超急排斥的发生。
(二)急性排斥
急性排斥(acute rejection)是排斥反应中最常见的一种类型,一般于移植后数天到几个月内发生,进行迅速。肾移植发生急性排斥时,可表现为体温度升高、局部胀痛、肾功能降低、少尿甚至无尿、尿中白细胞增多或出现淋巴细胞尿等临床症状。细胞免疫应答是急性移植排斥的主要原因,CD4+T(TH1)细胞和CD8+TC细胞是主要的效应细胞。即使进行移植前HLA配型及免疫抑制药物的应用,仍有30%~50%的移植受者会发生急性排斥。大多数急性排斥可通过增加免疫抑制剂的用量而得到缓解。
(三)慢性排斥
慢性排斥(chronic rejection)一般在器官移植后数月至数年发生,主要病理特征是移植器官的毛细血管床内皮细胞增生,使动脉腔狭窄,并逐渐纤维化。慢性免疫性炎症是导致上述组织病理变化的主要原因。目前对慢性排斥尚无理想的治疗措施。
移植物抗宿主反应
如果免疫攻击方向是由移植物针对宿主,即移植物中的免疫细胞对宿主的组织抗原产生免疫应答并引起组织损伤,则称为移植物抗宿主反应(graft versus host reaction,GVHR)。GVHR的发生需要一些特定的条件:①宿主与移植物之间的组织相容性不合;②移植物中必需含有足够数量的免疫细胞;③宿主处于免疫无能或免疫功能严重缺损状态。GVHR主要见于骨髓移植后。此外,脾、胸腺移植时,以及免疫缺陷的新生儿接受输血时,均可发生不同程度的GVHR。
急性GVHR一般发生于骨髓移植后10―70天内。如果去除骨髓中的T细胞,则可避免GVHR的发生,说明骨髓中T细胞是引起GVHR的主要效应细胞。但临床观察发现,去除骨髓中的T细胞后,骨髓植入的成功率也下降,白血病的复发率,病毒、真菌的感染率也都升高。这说明,骨髓中的T细胞有移植物抗白血病的作用,可以压倒残留的宿主免疫细胞,避免宿主对移植物的排斥作用;也可以在宿主免疫重建不全时,发挥抗微生物感染的作用。因此,选择性地去针对宿主移植抗原的T细胞,而保留其余的T细胞,不但可以避免GVHR,而且可以保存其保护性的细胞免疫功能。
 爱华网
爱华网