动力学同位素效应是指在化学反应过程中,反应物因同位素取代而改变了能态,从而引起化学反应速率的差异。1933年G.N.路易斯等用电解水的方法获得接近纯的重水,证实同位素取代对化学反应速率确有影响。
同位素效应_动力学同位素效应 -简介
动力学同位素效应(Kineticisotopeeffect)j是指在化学反应过程中,反应物因同位素取代而改变了能态,从而引起化学反应速率的差异。
1933年G.N.路易斯等用电解水的方法获得接近纯的重水,证实同位素取代对化学反应速率确有影响。
大多数元素的动力学同位素效应很小,但对于汗和氘,动力学同位素效应较大,它们的分离系数=H/D可以达到2~10左右,式中为化学反应速率常数。
同位素效应_动力学同位素效应 -产生
早期动力学同位素效应是用经典的碰撞理论来解释的。1949年J.比格尔艾森建立了动力学同位素效应的统计理论。在溶液中进行的化学反应,由于溶剂的同位素取代,而产生溶剂同位素效应。动力学同位素效应是分离同位素的重要根据之一,还可用来研究化学反应机理和溶液理论。
同位素效应_动力学同位素效应 -应用
在有机反应机理的研究中,一种特殊的取代基效应,即同位素原子作为取代基产生的效应,已被广泛地应用.通过测定化学反应中由于同位素所具有的特性而提供各种有价值的信息,进而结合其他信息推测出比较合理的反应历程.
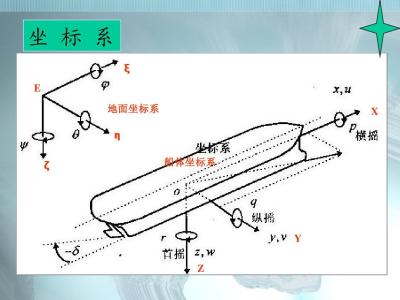
目前主要有两种应用同位素的方法,其一,作为示踪原子;其二,测量同位素取代时引起反应速率的变化.
 爱华网
爱华网