氮气,元素周期表第7位,化学式N2,通常状况下是一种无色无味的气体,且通常无毒,而且一般氮气比空气密度小。氮气占大气总量的78.12%(体积分数),是空气的主要成份。在标准大气压下,冷却至-195.6℃时,变成没有颜色的液体。在标准大气压下,冷却至-218.8℃时,液态氮变成雪状的固体。氮气的化学性质并不活泼,常温下氮气很难跟其他物质发生反应,但在高温、高能量条件下可与某些物质发生化学变化,用来制取对人类有用的新物质。
氮气密度_氮气 -物理性质
氮气在常况下是一种无色无味的气体,且通常无毒。氮气占空气总量的78.12%(体积分数),在标准情况下的气体密度是1.25g/L,氮气难溶于水,在常温常压下,1体积水中大约只溶解0.02体积的氮气。氮气是难液化的气体。氮气在极低温下会液化成无色液体,进一步降低温度时,更会形成白色晶状固体。在生产中,通常采用黑色钢瓶盛放氮气。其他物理性质见下表:
项 目化学式相对分子质量CAS登录号EINECS登录号英文名称熔点沸点,101.325kPa(1atm)时临界温度临界压力临界体积临界密度临界压缩系数液体密度,-180℃时液体热膨胀系数,-180℃时表面张力,-210℃时气体密度,101.325 kPa(atm)和70F(21.1℃)时气体相对密度,101.325 kPa(1atm)和70F时(空气=1)汽化热,沸点下熔化热,熔点下气体定压比热容cp,25℃时气体定容比热容cv,25℃时气体比热容比,cp/cv液体比热容,-183℃时固体比热容,-223℃时溶解度参数液体摩尔体积在水中的溶解度,25℃时气体黏度,25℃时液体黏度,-150℃时气体热导率,25℃ 时液体热导率,-150℃时属 性N228.0137727-37-9231-783-9Nitrogen63.15K,-210℃77.35K,-195.8℃126.1K,-147.05℃3.4MPa,33.94bar,33.5atm,492.26psia90.1cm3/mol0.3109g/cm30.2920.729g/cm30.00753 1/℃12.2×10-3 N/m,12.2dyn/cm1.160kg/m3,0.0724 lb/ft30.967202.76kJ/kg,87.19 BTU/1b25.7kJ/kg,11.05 BTU/1b1.038kJ/(kg・ k),0.248 BTU/(1b・R)0.741kJ/(kg・ k),0.177 BTU/(1b・R)1.4012.13kJ/(kg・k),0.509 BTU/(1b・R)1.489kJ/(kg・k),0.356 BTU/(1b・R)9.082(J/cm3)0.534.677cm3/mol17.28×10-6(w)175.44×10-7Pa・s,175.44μP0.038mPa ・s,0.038 cp0.02475W/(m ・ K)0.0646W/(m ・ K)氮气密度_氮气 -发现
氮气在大气中虽多于氧气,由于它的性质不活泼,所以人们在认识氧气之后才认识氮气的。不过它的发现却早于氧气。1575年英国化学家布拉克(Black,J.1728-1799)发现碳酸气之后不久,发现木炭在玻璃罩内燃烧后所生成的碳酸气,即使用苛性钾溶液吸收后仍然有较大量的空气剩下来。后来他的学生D・卢瑟福继续用动物做实验,把老鼠放进封闭的玻璃罩里直至其死后,发现玻璃罩中空气体积减少1/10;若将剩余的气体再用苛性钾溶液吸收,则会继续减少1/11的体积。D・卢瑟福发现老鼠不能生存的空气里燃烧蜡烛,仍然可以见到微弱的烛光;待蜡烛熄灭后,往其中放入少量的磷,磷仍能燃烧一会,对除掉空气中的助燃气来说,效果是好的。把磷燃烧后剩余的气体进行研究,D・卢瑟福发现这气体不能维持生命,具有灭火性质,也不溶于苛性钾溶洲,因此命名为“浊气”或“毒气”。在同一年,普利斯特里作类似的燃烧实验,发现使1/5的空气变为碳酸气,用石灰水吸收后的气体不助燃也不助呼吸。由于他同D・卢瑟福都是深信燃素学说的,因此他们把剩下来的气体叫做“被燃素饱和了的空气”。
氮气密度_氮气 -氮气用途
化工合成
氮主要用于合成氨,反应式为N2+3H2?2NH3( 条件为高压,高温、和催化剂。反应为可逆反应)还是合成纤维(锦纶、腈纶),合成树脂,合成橡胶等的重要原料。 氮是一种营养元素还可以用来制作化肥。例如:碳酸氢铵NH4HCO3,氯化铵NH4Cl,硝酸铵NH4NO3等等。
汽车轮胎
1.提高轮胎行驶的稳定性和舒适性
氮气几乎为惰性的双原子气体,化学性质极不活泼,气体分子比氧分子大,不易热胀冷缩,变形幅度小,其渗透轮胎胎壁的速度比空气慢约30~40%, 能保持稳定胎压,提高轮胎行驶的稳定性,保证驾驶的舒适性;氮气的音频传导性低,相当于普通空气的1/5,使用氮气能有效减少轮胎的噪音,提高行驶的宁静度。
2.防止爆胎和缺气碾行
爆胎是公路交通事故中的头号杀手。据统计,在高速公路上有46%的交通事故是由于轮胎发生故障引起的,其中爆胎一项就占轮胎事故总量的70%。汽车行驶时,轮胎温度会因与地面磨擦而升高,尤其在高速行驶及紧急刹车时,胎内气体温度会急速上升,胎压骤增,所以会有爆胎的可能。而高温导致轮胎橡胶老化,疲劳强度下降,胎面磨损剧烈,又是可能爆胎的重要因素。而与一般高压空气相比,高纯度氮气因为无氧且几乎不含水份不含油,其热膨胀系数低,热传导性低,升温慢,降低了轮胎聚热的速度,不可燃也不助燃等特性,所以可大大地减少爆胎的几率。
3.延长轮胎使用寿命
使用氮气后,胎压稳定体积变化小,大大降低了轮胎不规则磨擦的可能性,如冠磨、胎肩磨、偏磨,提高了轮胎的使用寿命;橡胶的老化是受空气中的氧分子氧化所致,老化后其强度及弹性下降,且会有龟裂现象,这时造成轮胎使用寿命缩短的原因之一。氮气分离装置能极大限度地排除空气中的氧气、硫、油、水和其它杂质,有效降低了轮胎内衬层的氧化程度和橡胶被腐蚀的现象,不会腐蚀金属轮辋,延长了轮胎的使用寿命,也极大程度减少轮辋生锈的状况。
4.减少油耗,保护环境
氮气弹簧
轮胎胎压的不足与受热后滚动阻力的增加,会造成汽车行驶时的油耗增加;而氮气除了可以维持稳定的胎压,延缓胎压降低之外,其干燥且不含油不含水,热传导性低,升温慢的特性,减低了轮胎行走时温度的升高,以及轮胎变形小抓地力提高等,降低了滚动阻力,从而达到减少油耗的目的。
其他作用
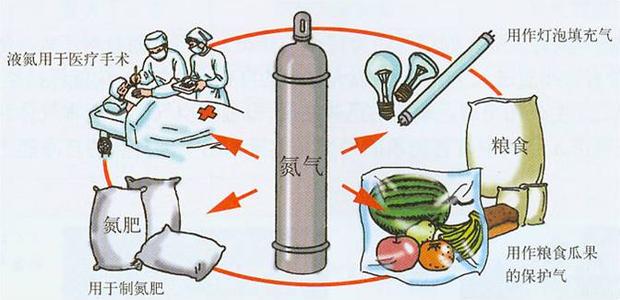
由于氮的化学惰性,常用作保护气体,如:瓜果,食品,灯泡填充气。以防止某些物体暴露于空气时被氧所氧化,用氮气填充粮仓,可使粮食不霉烂、不发芽,长期保存。液氮还可用作深度冷冻剂。作为冷冻剂在医院做除斑,包,豆等的手术时常常也使用, 即将斑,包,豆等冻掉,但是容易出现疤痕,并不建议使用。高纯氮气用作色谱仪等仪器的载气。用作铜管的光亮退火保护气体。跟高纯氦气、高纯二氧化碳一起用作激光切割机的激光气体。氮气也作为食品保鲜保护气体的用途。在化工行业,氮气主要用作保护气体、置换气体、洗涤气体、安全保障气体。用作铝制品、铝型材加工,铝薄轧制等保护气体。用作回流焊和波峰焊配套的保护气体,提高焊接质量。用作浮法玻璃生产过程中的保护气体,防锡槽氧化。
氮气密度_氮气 -制备方法
现场制氮/工业制氮
现场制氮是指氮气用户自购制氮设备制氮,工业规模制氮有三类:即深冷空分制氮、变压吸附制氮和膜分离制氮。利用各空气的沸点不同使用液态空气分离法,将氧气和氮气分离。将装氮气的瓶子漆成黑色,装氧气的漆成蓝色。
实验室制法
氮气气氛炉
制备少量氮气的基本原理是用适当的氧化剂将氨或铵盐氧化,最常
用的是如下几种方法:
⑴加热亚硝酸铵的溶液: (343k)NHNO ===== N↑+ 2HO
⑵亚硝酸钠与氯化铵的饱和溶液相互作用: NHCl + NaNO === NaCl + 2HO + N↑
⑶将氨通过红热的氧化铜: 2 NH + 3 CuO === 3 Cu + 3 HO + N
⑷氨水与溴水反应:8 NH + 3 Br (aq) === 6 NHBr + N↑
⑸重铬酸铵加热分解: (NH)CrO===N↑+CrO+4HO
{6}加热叠氮化钠,使其热分解,可得到很纯的氮气,2NaN===2Na+3N↑
深冷空分制氮
它是一种传统的空分技术,已有九十余年的历史,它的特点是产气量大,产品氮纯度高,无须再纯化便可直接应用于磁性材料,但它工艺流程复杂,占地面积大,基建费用高,需专门的维修力量,操作人员较多,产气慢(18~24h),它适宜于大规模工业制氮,氮气成本在0.7元/m3左右。
变压吸附制氮
变压吸附(Pressure Swing Adsorption,简称PSA)气体分离技术是非低温气体分离技术的重要分支,是人们长期来努力寻找比深冷法更简单的空分方法的结果。七十年代西德埃森矿业公司成功开发了碳分子筛,为PSA空分制氮工业化铺平了道路。三十年来该技术发展很快,技术日趋成熟,在中小型制氮领域已成为深冷空分的强有力的竞争对手。
变压吸附制氮是以空气为原料,用碳分子筛作吸附剂,利用碳分子筛对空气中的氧和氮选择吸附的特性,运用变压吸附原理(加压吸附,减压解吸并使分子筛再生)而在常温使氧和氮分离制取氮气。
变压吸附制氮与深冷空分制氮相比,具有显着的特点:吸附分离是在常温下进行,工艺简单,设备紧凑,占地面积小,开停方便,启动迅速,产气快(一般在30min左右),能耗小,运行成本低,自动化程度高,操作维护方便,撬装方便,无须专门基础,产品氮纯度可在一定范围内调节,产氮量≤2000Nm/h。但到目前为止,除美国空气用品公司用PSA制氮技术,无须后级纯化能工业化生产纯度≥99.999%的高纯氮外(进口价格很高),国内外同行一般用PSA制氮技术只能制取氮气纯度为99.9%的普氮(即O≤0.1%),个别企业可制取99.99%的纯氮(O≤0.01%),纯度更高从PSA制氮技术上是可能的,但制作成本太高,用户也很难接受,所以用非低温制氮技术制取高纯氮还必须加后级纯化装置。
膜分离空分制氮
膜分离空分制氮也是非低温制氮技术的新的分支,是80年代国外迅速发展起来的一种新的制氮方法,在国内推广应用还是近几年的事。
膜分离制氮是以空气为原料,在一定的压力下,利用氧和氮在中空纤维膜中的不同渗透速率来使氧、氮分离制取氮气。它与上述两种制氮方法相比,具有设备结构更简单、体积更小、无切换阀门、操作维护也更为简便、产气更快(3min以内)、增容更方便等特点,但中空纤维膜对压缩空气清洁度要求更严,膜易老化而失效,难以修复,需要换新膜,膜分离制氮比较适合氮气纯度要求在≤98%左右的中小型用户,此时具有最佳功能价格比;当要求氮气纯度高于98%时,它与同规格的变压吸附制氮装置相比,价格要高出30%左右,故由膜分离制氮和氮纯化装置相组合制取高纯氮时,普氮纯度一般为98%,因而会增加纯化装置的制作成本和运行成本。
氮气纯化方法
加氢除氧法
高压氮气压缩机增压机,
在催化剂作用下,普氮中残余氧和加入的氢发生化学反应生成水,其反应式:2H+O=2HO,再通过后级干燥除去水份,而获得下列主要成份的高纯氮:N≥99.999 %,O≤5×10-6,H≤1500×10,H
O≤10.7×10。制氮成本在0.5元/m左右。
加氢除氧、除氢法
此法分三级,第一级加氢除氧,第二级除氢,第三级除水,获得下列组成的高纯氮:N≥99.999%,O≤5×10,H≤5×10,HO≤10.7×10。制氮成本在0.6元/m3左右。
碳脱氧法
在碳载型催化剂作用下(在一定温度下),普氮中之残氧和催化剂本身提供的碳发生反应,生成CO。反应式:C+O=CO。再经过后级除CO和HO获得下列组成的高纯氮气:N≥99.999%,O≤5×10,CO≤5×10,HO≤10.7×10。制氮成本在0.6元/m左右。
优劣评比
上述三种氮气纯化方法中,方法(1)因成品氮中H2量过高满足不了磁性材料的要求,故不采用;方法(2)成品氮纯度符合磁性材料用户的要求,但需氢源,而且氢气在运输、贮存、使用中都存在不安全因素;方法(3)成品氮的质量完全可满足磁性材料的用气要求,工艺中不使用H,无加氢法带来的问题,氮中无H且成品氮的质量不受普氮波动的影响,故和其他氮气纯法相比,氮气质量更加稳定,是最适合磁性材料行业中一种氮气纯化方法。
氮气密度_氮气 -化学名称
化学品中文名称:氮气
化学品英文名称: nitrogen
技术说明书编码: 33
CAS No.: 7727-37-9
分子式: N
分子量: 28.01
氮气密度_氮气 -成分信息
有害物成分 含量 CAS No.
氮 ≥99.5% 7727-37-9
含量约占空气的78%
氮气密度_氮气 -注意事项
危险性
危险性类别:第2.2类惰性气体
侵入途径:吸入
健康危害:空气中氮气含量过高,使吸入气氧分压下降,引起缺氧窒息。吸入氮气浓度不太高时,患者最初感胸闷、气短、疲软无力;继而有烦躁不安、极度兴奋、乱跑、叫喊、神情恍惚、步态不稳,称之为“氮酩酊”,可进入昏睡或昏迷状态。吸入高浓度,患者可迅速昏迷、因呼吸和心跳停止而死亡。
潜水员深潜时,可发生氮的麻醉作用;若从高压环境下过快转入常压环境,体内会形成氮气气泡,压迫神经、血管或造成徽血管阻塞,发生“减压病”。
环境危害:无
燃爆危险:本品不燃。
急救措施
皮肤接触:没事(因空气中就含有约78%的氮)
眼睛接触:没事(理由同上)
吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。呼吸心跳停止时,立即进行人工呼吸和胸外心脏按压术。就医。
食入:没事
消防措施
危险特性:若遇高热,容器内压增大,有开裂和爆炸的危险。
有害燃烧产物:氮气。
灭火方法:本品不燃。尽可能将容器从火场移至空旷处。喷水保持火场容器冷却,直至灭火结束用雾状水保持火场中容器冷却。可用雾状水喷淋加速液氮蒸发,但不可使用水枪射至液氮。
泄漏应急处理
应急处理:迅速撤离泄漏污染区人员至上风处,并进行隔离,严格限制出入。建议应急处理人员戴自给正压式呼吸器,穿一般作业工作服。尽可能切断泄漏源。合理通风,加速扩散。漏气容器要妥善处理,修复、检验后再用。
操作处置储存
操作注意事项:密闭操作。密闭操作,提供良好的自然通风条件。操作人员必须经过专门培训,严格遵守操作规程。防止气体泄漏到工作场所空气中。搬运时轻装轻卸,防止钢瓶及附件破损。配备泄漏应急处理设备。
储存注意事项:储存于阴凉、通风的库房。远离火种、热源。库温不宜超过30℃。储区应备有泄漏应急处理设备。
接触控制
职业接触限值:
中国MAC(mg/m3):未制定标准前苏联MAC(mg/m3):未制定标准TLVTN:ACGIH 窒息性气体TLVWN:未制定标准监测方法:
工程控制:密闭操作。提供良好的自然通风条件。
呼吸系统防护:一般不需特殊防护。当作业场所空气中氧气浓度低于18%时,必须佩戴空气呼吸器、长管面具。
眼睛防护:一般不需特殊防护。
身体防护:穿一般作业工作服。
手防护:戴一般作业防护手套。
其它防护:避免高浓度吸入。进入罐、限制性空间或其它高浓度区作业,须有人监护。
氮气密度_氮气 -理化特性
物理性质
单质氮在常况下是一种无色无嗅的气体,在标准情况下的气体密度是1.25g・dm-3,熔点63K( -209.8℃),沸点75K(-195.6℃),临界温度为126K,它是个难于液化的气体。在水中的溶解度很小,在283K时,一体积水约可溶解0.02体积的N2。氮气在极低温下会液化成白色液体,进一步降低温度时,更会形成白色晶状固体。通常市场上供应的氮气都盛于黑色气体瓶中保存。不能燃烧,也不支持燃烧,不易溶于水(微溶)。
主要成分: 含量: 高纯氮≥99.999%; 工业级 一级≥99.5%; 二级≥98.5%。
外观与性状: 无色无臭气体。
pH:
熔点(℃): -209.8
沸点(℃): -195.6
相对密度(水=1): 0.81(-196℃)
相对蒸气密度(空气=1): 0.966
饱和蒸气压(kPa): 1026.42(-173℃)
燃烧热(kJ/mol): 无意义
临界温度(℃): -147
临界压力(MPa): 3.40
辛醇/水分配系数的对数值: 无资料
闪点(℃): 无意义
引燃温度(℃): 无意义
爆炸上限%(V/V): 无意义
爆炸下限%(V/V): 无意义
溶解性: 微溶于水、乙醇。
主要用途: 用于合成氨,制硝酸,用作物质保护剂,冷冻剂。 汽车维修中轮胎加气、空调系统维护检修、检漏测试等。
化学性质
氮气分子的分子轨道式为 ,对成键有贡献的是 三对电子,即形成两个π键和一个σ键。 对成键没有贡献,成键与反键能量近似抵消,它们相当于孤电子对。由于N2分子中存在叁键N≡N,所以N2分子具有很大的稳定性,将它分解为原子需要吸收941.69kJ/mol的能量。N2分子是已知的双原子分子中最稳定的。
检验方法:
将燃着的Mg条伸入盛有氮气的集气瓶,Mg条会继续燃烧
提取出燃烧剩下的灰烬(白色粉末Mg3N2),加入少量水,产生使湿润的红色石蕊试纸变蓝的气体(氨气)
反应方程式
3Mg+N2=(条件:点燃)Mg3N2(氮化镁)
Mg3N2+6H2O=3Mg(OH)2+2NH3 ↑
由氮元素的氧化态-吉布斯自由能图也可以看出,除了NH4离子外,氧化数为0的N2分子在图中曲线的最低点,这表明相对于其它氧化数的氮的化合物来讲,N2是热力学稳定状态。氧化数为0到+5之间的各种氮的化合物的值都位于HNO3和N2两点的连线(图中的虚线)的上方,因此,这些化合物在热力学上是不稳定的,容易发生歧化反应。在图中唯一的一个比N2分子值低的是NH4+离子。
由氮元素的氧化态-吉布斯自由能图和N2分子的结构均可以看出,单质N2不活泼,只有在高温高压并有催化剂存在的条件下,氮气可以和氢气反应生成氨: N2+3H2=高温高压催化剂=2NH3
在放电条件下,氮气才可以和氧气化合生成一氧化氮: N2+O2=放电=2NO
在水力发电很发达的国家,这个反应已用于生产硝酸。
N2与电离势小,而且其氮化物具有高晶格能的金属能生成离子型的氮化物。例如:
第IA族的金属锂在常温下就可直接反应:
6Li + N2=== 2 Li3N
第IIA族碱土金属Mg 、Ca 、Sr 、Ba 在炽热的温度下作用:
3Ca + N2=== Ca3N2
第IIIA族的硼和铝要在白热的温度才能反应:
2 B + N2=== 2 BN (大分子化合物)
N2与硅和其它族元素的单质一般要在高于1473K的温度下才能反应。第IA族的金属除上述的锂外都不直接和氮气发生反应,但可用间接的方法得到这些金属元素的氮化物。
氮的制备
单质氮一般是由液态空气的分馏而制得的,常以1.5210Mpa的压力把氮气装在气体钢瓶中运输和使用。一般钢瓶中氮气的纯度约99.7% 。
实验室中制备少量氮气的基本原理是用适当的氧化剂将氨或铵盐氧化,最常用的是如下几种方法:
⑴加热亚硝酸铵的溶液:
NH4NO2(aq.)==△==N2↑+H20
⑵亚硝酸钠与氯化铵的饱和溶液相互作用:
NH4Cl(饱和) + NaNO2(饱和) === NaCl + 2 H2O + N2↑
⑶将氨通过红热的氧化铜:
2 NH3+ 3 CuO === 3 Cu + 3 H2O + N2↑
⑷氨与溴水反应:
8 NH3 + 3 Br2 (aq) === 6 NH4Br + N2↑
⑸重铬酸铵加热分解:
(NH4)2Cr2O7(s)==△==N2↑+Cr2O3+4H2O
氮的用途
氮主要用于合成氨,由此制造化肥、硝酸和炸药等,氨还是合成纤维(锦纶、腈纶),合成树脂,合成橡胶等的重要原料。由于氮的化学惰性,常用作保护气体。以防止某些物体暴露于空气时被氧所氧化,用氮气填充粮仓,可使粮食不霉烂、不发芽,长期保存。液氨还可用作深度冷冻剂。
氮的成键特征和价键结构
由于单质N2在常况下异常稳定,人们常误认为氮是一种化学性质不活泼的元素。实际上相反,元素氮有很高的化学活性。N的电负性(3.04)仅次于F和O,说明它能和其它元素形成较强的键。另外单质N2分子的稳定性恰好说明N原子的活泼性。问题是目前人们还没有找到在常温常压下能使N2分子活化的最优条件。但在自然界中,植物根瘤上的一些细菌却能够在常温常压的低能量条件下,把空气中的N2转化为氮化合物,作为肥料供作物生长使用。所以固氮的研究一直是一个重要的科学研究课题。因此我们有必要详细了解氮的成键特性和价键结构。
N原子的价电子层结构为2s2p3,即有3个成单电子和一对孤电子对,以此为基础,在形成化合物时,可生成如下三种键型:
1.形成离子键
2.形成共价键
3.形成配位键
形成离子键
N原子有较高的电负性(3.04),它同电负性较低的金属,如Li(电负性0.98)、Ca(电负性1.00)、Mg(电负性1.31)等形成二元氮化物时,能够获得3个电子而形成N3-离子。
N2+ 6 Li == 2 Li3N
N2+ 3 Ca == Ca3N2
N2+ 3 Mg == Mg3N2
N3-离子的负电荷较高,半径较大(171pm),遇到水分子会强烈水解,因此的离子型化合物只能存在于干态,不会有N3-的水合离子。
形成共价键
N原子同电负性较高的非金属形成化合物时,形成如下几种共价键:
⑴N原子采取sp3杂化态,形成三个共价键,保留一对孤电子对,分子构型为三角锥型,例如NH3、NF3、NCl3等。
若形成四个共价单键,则分子构型为正四面体型,例如NH4+离子。
⑵N原子采取sp2杂化态,形成2个共价键和一个键,并保留有一对孤电子对,分子构型为角形,例如Cl―N=O 。(N原子与Cl 原子形成一个σ 键和一个π键,N原子上的一对孤电子对使分子成为角形。)
若没有孤电子对时,则分子构型为三角形,例如HNO3分子或NO3-离子。硝酸分子中N原子分别与三个O原子形成三个σ键,它的π轨道上的一对电子和两个O原子的成单π电子形成一个三中心四电子的不定域π键。在硝酸根离子中,三个O原子和中心N原子之间形成一个四中心六电子的不定域大π键。
这种结构使硝酸中N原子的表观氧化数为+5,由于存在大π键,硝酸盐在常况下是足够稳定的。
⑶N原子采取sp 杂化,形成一个共价叁键,并保留有一对孤电子对,分子构型为直线形,例如N2分子和CN-中N原子的结构。
形成配位键
N原子在形成单质或化合物时,常保留有孤电子对,因此这样的单质或化合物便可作为电子对给予体,向金属离子配位。例如[Cu(NH3)4]2+。
稳定性:较稳定
禁配物:无资料
避免接触的条件:无资料
聚合危害: 无资料
分解产物: 单质,不分解
氮气密度_氮气 -反应活性
稳定性:稳定
禁配物:
避免接触的条件:
聚合危害:聚合
燃烧分解产物:氮气。
氮气密度_氮气 -毒理学
急性毒性:LD50
LD50:在毒理学中,半数致死量(median lethal dose),简称LD50(即Lethal Dose, 50'),是描述有毒物质或辐射的毒性的常用指标。按照医学主题词表(MeSH)的定义,LD50是指能杀死一半试验总体之有害物质、有毒物质或游离辐射的剂量。这测试最先由J.W. Trevan于1927年发明。
亚急性和慢性毒性:无
刺激性:无
致敏性:无
致突变性:不明
致畸性:无
致癌性:无
氮气密度_氮气 -生态学
生态毒理毒性:
生物降解性:
非生物降解性:
生物富集或生物积累性:
其它有害作用: 无资料。
第十三部分:废弃处置
废弃物性质:
废弃处置方法: 处置前应参阅国家和地方有关法规。废气直接排入大气。
废弃注意事项:
氮气密度_氮气 -运输信息
危险货物编号:22005
UN编号:1066
包装标志:不燃气体
包装类别:O53
包装方法:钢质气瓶;安瓿瓶外普通木箱。
运输注意事项:采用钢瓶运输时必须戴好钢瓶上的安全帽。钢瓶一般平放,并应将瓶口朝同一方向,不可交叉;高度不得超过车辆的防护栏板,并用三角木垫卡牢,防止滚动。严禁与易燃物或可燃物等混装混运。夏季应早晚运输,防止日光曝晒。铁路运输时要禁止溜放。
氮气密度_氮气 -法规信息
法规信息 化学危险物品安全管理条例 ,化学危险物品安全管理条例实施细则 (化劳发 677号),工作场所安全使用化学品规定 (劳部发423号)等法规,针对化学危险品的安全使用、生产、储存、运输、装卸等方面均作了相应规定;常用危险化学品的分类及标志 (GB 13690-92)将该物质划为第2.2 类不燃气体。其它法规:工业用气态氮 (GB3864-83)。
氮气密度_氮气 -氮的氧化物
氮可以形成多种不同的氧化物。在氧化物中,氮的氧化数可以从+1到+5。其中以NO和较为重要。
氮的氧化物的性质如下表:
名称化学式状态颜色化学性质熔点(℃)沸点(℃)一般用途一氧化二氮N2O气态无色稳定,注:即是笑气-90.8-88.5火箭和赛车的氧化剂及增加发动机的输出功率。一氧化氮NO气态无色(固态、液态时为蓝色)反应能力适中-163.6-151.8引起血管的扩张而引起勃起和生产硝酸三氧化二氮N2O3液态蓝色室温下分解为NO和NO2-102-3.5(分解)二氧化氮NO2气态红棕色强氧化性-11.221.2生产硝酸四氧化二氮N2O4气态无色强烈地分解为NO2-9221.3火箭推进剂组分中的氧化剂五氧化二氮N2O5固态无色不稳定3047(分解)氮气密度_氮气 -其他资料
“NO NUCLEAR”(非核武器)的缩写,但威力却能达到小型战术核武器的程度。
其爆炸的高温可以瞬间熔化任何物质,连A.T.FIELD都无法完全防御
N2总线
在楼宇自控中使用的控制线,如江森自控的Metasys N2总线,
可支持Metasys N1 网和Metasys BACnet网;
N2网联接网络控制器和现场监控设备;
使用RS/485协议,主从协议;
支持大约100个现场设备;
如果管理网络采用BACnet协议, N2总线支持大约50个现场设备(N30网络控制器) ;
 爱华网
爱华网