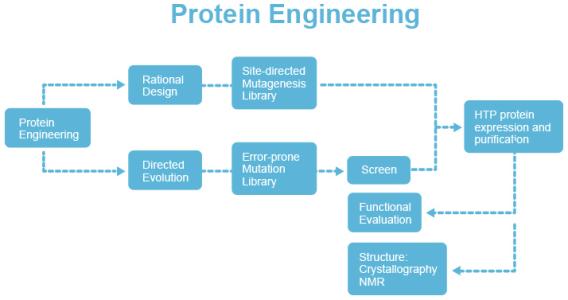
按人们意志改变蛋白质的结构和功能或创造新的蛋白质的过程。包括在体外改造已有的蛋白质,化学合成新的蛋白质,通过基因工程手段改造已有的或创建新的编码蛋白质的基因去合成蛋白质等。为获得的新蛋白具备有意义的新性质或新功能,常对已知的其他蛋白质进行模式分析或采取分子进化等手段。
所谓蛋白质工程,
蛋白质工程就是利用基因工程手段,包括基因的定点突变和基因表达对蛋白质进行改造,以期获得性质和功能更加完善的蛋白质分子。
蛋白质工程_蛋白质工程 -简介
蛋白质是生命的体现者,离开了蛋白质,生命将不复存在。可是,生物体内存在的天然蛋白质,有的往往不尽人意,需要进行改造。由于蛋白质是由许多氨基酸按一定顺序连接而成的,每一种蛋白质有自己独特的氨基酸顺序,所以改变其中关键的氨基酸就能改变蛋白质的性质。而氨基酸是由三联体密码决定的,只要改变构成遗传密码的一个或两个碱基就能达到改造蛋白质的目的。蛋白质工程的一个重要途径就是根据人们的需要,对负责编码某种蛋白质的基因重新进行设计,使合成的蛋白质变得更符合人类的需要。这种通过造成一个或几个碱基定点突变,以达到修饰蛋白质分子结构目的的技术,称为基因定点突变技术。
蛋白质工程是在基因重组技术、生物化学、分子生物学、分子遗传学等学科的基础之上,融合了蛋白质晶体学、蛋白质动力学、蛋白质化学和计算机辅助设计等多学科而发展起来的新兴研究领域。其内容主要有两个方面:根据需要合成具有特定氨基酸序列和空间结构的蛋白质;确定蛋白质化学组成、空间结构与生物功能之间的关系。在此基础之上,实现从氨基酸序列预测蛋白质的空间结构和生物功能,设计合成具有特定生物功能的全新的蛋白质,这也是蛋白质工程最根本的目标之一。
目前,蛋白质工程尚未有统一的定义。一般认为蛋白质工程就是通过基因重组技术改变或设计合成具有特定生物功能的蛋白质。实际上蛋白质工程包括蛋白质的分离纯化,蛋白质结构和功能的分析、设计和预测,通过基因重组或其它手段改造或创造蛋白质。从广义上来说,蛋白质工程是通过物理、化学、生物和基因重组等技术改造蛋白质或设计合成具有特定功能的新蛋白质。
蛋白质工程_蛋白质工程 -基本途径
从预期的蛋白质功能出发→设计预期的蛋白质结构→推测应有的氨基酸序列→找到相对应的脱氧核苷酸(基因)
蛋白质工程_蛋白质工程 -特点
蛋白质工程在食品工业、日用品工业方面有广泛的应用前景。比如用经过改造的稳定性好的酶,可由价格便宜的棕榈油生产出价格昂贵的可可脂,从而创造很高的经济效益。荷兰一家公司设计了一种能和漂白剂一同起作用的去污酶,并且通过对这种酶上的两个氨基酸的修改,使这种酶具有较高抵抗力,在洗涤过程中不受破坏。因此,通过蛋白质工程可实现常规酶工程手段不能实现的目标。
在医学上,蛋白质工程也具有广泛的应用前景。比如,用人工手段去改造某些致癌基因的产物――蛋白质,使它失去致癌作用,从而开辟治疗癌症的新途径。中国的蛋白质工程具有国际先进水平,这些工程包括重组人胰岛素和溶血栓药物,重组人尿激酶等。
对动植物体内参与重要生命活动的酶加以修饰和改造,是蛋白质工程未来发展的一个重要目标。有朝一日,人们一定能够通过蛋白质工程来设计、控制那些与DNA相互作用的调控蛋白质,到那时,人为控制遗传、改造生命就不再是天方夜谭了。
蛋白质工程_蛋白质工程 -研究的核心内容
蛋白质结构分析
蛋白质工程的核心内容之一就是收集大量的蛋白质分子结构的信息,以便建立结构与功能之间关系的数据库,为蛋白质结构与功能之间关系的理论研究奠定基础。三维空间结构的测定是验证蛋白质设计的假设即证明是新结构改变了原有生物功能的必需手段。晶体学的技术在确定蛋白质结构方面有了很大发展,但是最明显的不足是需要分离出足够量的纯蛋白质(几毫克~几十毫克),制备出单晶体,然后再进行繁杂的数据收集、计算和分析。
另外,蛋白质的晶体状态与自然状态也不尽相同,在分析的时候要考虑到这个问题。核磁共振技术可以分析液态下的肽链结构,这种方法绕过了结晶、X-射线衍射成像分析等难点,直接分析自然状态下的蛋白质的结构。现代核磁共振技术已经从一维发展到三维,在计算机的辅助下,可以有效地分析并直接模拟出蛋白质的空间结构、蛋白质与辅基和底物结合的情况以及酶催化的动态机理。从某种意义上讲,核磁共振可以更有效地分析蛋白质的突变。国外有许多研究机构正在致力于研究蛋白质与核酸、酶抑制剂与蛋白质的结合情况,以开发
具有高度专一性的药用蛋白质。
结构、功能的设计和预测
根据对天然蛋白质结构与功能分析建立起来的数据库里的数据,可以预测一定氨基酸序列肽链空间结构和生物功能;反之也可以根据特定的生物功能,设计蛋白质的氨基酸序列和空间结构。通过基因重组等实验可以直接考察分析结构与功能之间的关系;也可以通过分子动力学、分子热力学等,根据能量最低、同一位置不能同时存在两个原子等基本原则分析计算蛋白质分子的立体结构和生物功能。虽然这方面的工作尚在起步阶段,但可预见将来能建立一套完整的理论来解释结构与功能之间的关系,用以设计、预测蛋白质的结构和功能。
创造和改造
蛋白质的改造,从简单的物理、化学法到复杂的基因重组等等有多种方法。物理、化学法:对蛋白质进行变性、复性处理,修饰蛋白质侧链官能团,分割肽链,改变表面电荷分布促进蛋白质形成一定的立体构像等等;生物化学法:使用蛋白酶选择性地分割蛋白质,利用转糖苷酶、酯酶、酰酶等去除或连接不同化学基团,利用转酰胺酶使蛋白质发生胶连等等。以上方法只能对相同或相似的基团或化学键发生作用,缺乏特异性,不能针对特定的部位起作用。采用基因重组技术或人工合成DNA,不但可以改造蛋白质而且可以实现从头合成全新的蛋白质。
蛋白质是由不同氨基酸按一定顺序通过肽键连接而成的肽构成的。氨基酸序列就是蛋白质的一级结构,它决定着蛋白质的空间结构和生物功能。而氨基酸序列是由合成蛋白质的基因的DNA序列决定的,改变DNA序列就可以改变蛋白质的氨基酸序列,实现蛋白质的可调控生物合成。在确定基因序列或氨基酸序列与蛋白质功能之间关系之前,宜采用随机诱变,造成碱基对的缺失、插入或替代,这样就可以将研究目标限定在一定的区域内,从而大大减少基因分析的长度。一旦目标DNA明确以后,就可以运用定位突变等技术来进行研究。
定位突变蛋白质中的氨基酸是由基因中的三联密码决定的,只要改变其中的一个或两个就可以改变氨基酸。通常是改变某个位置的氨基酸,研究蛋白质结构、稳定性或催化特性。噬菌体M13的生活周期有二个阶段,在噬菌体粒子中其基因组为单链,侵入宿主细胞以后,通过复制以双链形式存在。将待研究的基因插入载体M13,制得单链模板,人工合成一段寡核苷酸(其中含一个或几个非配对碱基)作为引物,合成相应的互补链,用T4连接酶连接成闭环双链分子。经转染大肠杆菌,双链分子在胞内分别复制,因此就得到两种类型的噬菌斑,含错配碱基的就为突变型。再转入合适的表达系统合成突变型蛋白质。
盒式突变1985年Wells提出的一种基因修饰技术――盒式突变,一次可以在一个位点上产生20种不同氨基酸的突变体,可以对蛋白质分子中重要氨基酸进行“饱和性”分析。利用定位突变在拟改造的氨基酸密码两侧造成两个原载体和基因上没有的内切酶切点,用该内切酶消化基因,再用合成的发生不同变化的双链DNA片段替代被消化的部分。这样一次处理就可以得到多种突变型基因。
PCR技术DNA聚合酶链式反应是应用最广泛的基因扩增技术。以研究基因为模板,用人工合成的寡核苷酸(含有一个或几个非互补的碱基)为引物,直接进行基因扩增反应,就会产生突变型基因。分离出突变型基因后,在合适的表达系统中合成突变型蛋白质。这种方法直接、快速和高效。
高突变率技术从大量的野生型背景中筛选出突变型是一项耗时、费力的工作。有两种新的突变方法具有较高的突变率:
1、硫代负链法:核苷酸间磷酸基的氧被硫替代后修饰物(α-(S)-dCTP)对某些内切酶有耐性,在有引物和(α-(S)-dCTP)存在下合成负链,然后用内切酶处理,结果仅在正链上产生“缺口”,用核苷酸外切酶III从3`→5`扩大缺口并超过负链上错配的核苷酸,在聚合酶作用下修复正链,就可以得到二条链均为突变型的基因;
2、UMP正链法:大肠杆菌突变株RZ1032中缺少脲嘧啶糖苷酶和UTP酶,M13在这种宿主中可以用脲嘧啶(U)替代胸腺嘧啶(T)掺入模板而不被修饰。用这种含U的模板产生的突变双链转化正常大肠杆菌,结果含U的正链被寄主降解,而突变型负链保留并复制。
蛋白质融合将编码一种蛋白质的部分基因移植到另一种蛋白质基因上或将不同蛋白质基因的片段组合在一起,经基因克隆和表达,产生出新的融合蛋白质。这种方法可以将不同蛋白质的特性集中在一种蛋白质上,显著地改变蛋白质的特性。现在研究的较多的所谓“嵌合抗体”和“人缘化抗体”等,就是采用的这种方法。
蛋白质工程_蛋白质工程 -实际应用
提高蛋白质的稳定性
葡萄糖异构酶(GI)在工业上应用广泛,为提高其热稳定性,朱国萍等人在确定第138位甘氨酸(Gly138)为目标氨基酸后,用双引物法对GI基因进行体外定点诱变,以脯氨酸(Pro138)替代Gly138,含突变体的重组质粒在大肠杆菌中表达,结果突变型GI比野生型的热半衰期长一倍;最适反应温度提高10~12℃;酶比活相同。据分析,Pro替代Gly138后,可能由于引入了一个吡咯环,该侧链刚好能够填充于Gly138附近的空洞,使蛋白质空间结构更具刚性,从而提高了酶的热稳定性。
融合蛋白质
脑啡肽(Enk)N端5肽线形结构是与δ型受体结合的基本功能区域,干扰素(IFN)是一种广谱抗病毒抗肿瘤的细胞因子。黎孟枫等人化学合成了EnkN端5肽编码区,通过一连接3肽编码区与人α1型IFN基因连接,在大肠杆菌中表达了这一融合蛋白。以体外人结肠腺癌细胞和多形胶质瘤细胞为模型,采用3H-胸腺嘧啶核苷掺入法证明该融合蛋白抑制肿瘤细胞生长的活性显著高于单纯的IFN,通过Naloxone竞争阻断实验证明,抑制活性的增高确由Enk导向区介导。
蛋白质活性的改变
通常饭后30~60min,人血液中胰岛素的含量达到高峰,120~180min内恢复到基础水平。而目前临床上使用的胰岛素制剂注射后120min后才出现高峰且持续180~240min,与人生理状况不符。实验表明,胰岛素在高浓度(大于10-5mol/L)时以二聚体形式存在,低浓度时(小于10-9mol/L)时主要以单体形式存在。设计速效胰岛素原则就是避免胰岛素形成聚合体。类胰岛素生长因子-I(IGF-I)的结构和性质与胰岛素具有高度的同源性和三维结构的相似性,但IGF-I不形成二聚体。IGF-I的B结构域(与胰岛素B链相对应)中B28-B29氨基酸序列与胰岛素B链的B28-B29相比,发生颠倒。因此,将胰岛素B链改为B28Lys-B29Pro,获得单体速效胰岛素。该速效胰岛素已通过临床实验。
治癌酶的改造
癌症的基因治疗分二个方面:药物作用于癌细胞,特异性地抑制或杀死癌细胞;药物保护正常细胞免受化学药物的侵害,可以提高化学治疗的剂量。疱症病毒(HSV)胸腺嘧啶激酶(TK)可以催化胸腺嘧啶和其他结构类似物如GANCICLOVIR和ACYCLOVIR无环鸟苷磷酸化。GANCICLOVIR和ACYCLOVIR缺少3`端羟基,就可以终止DNA的合成,从而杀死癌细胞。HSV-TK催化GANCICLOVIR和ACYCLOVIR的能力可以通过基因突变来提高。从大量的随机突变中筛选出一种,在酶活性部位附近有6个氨基酸被替换,催化能力分别提高43和20倍。O6-烷基-鸟嘌呤是DNA经烷基化剂(包括化疗用亚硝基药物)处理以后形成的主要诱变剂和细胞毒素,所以这些亚硝基药物的使用剂量受到限制。O6-烷基-鸟嘌呤-DNA烷基转移酶O6-Alkylguanine-DNAalkyltransferase(AGT)能够将鸟嘌呤O6上的烷基去除掉,起到保护作用。通过反向病毒转染,人类AGT在鼠骨髓细胞中表达并起到保护作用。通过突变处理,得到一些正突变AGT基因且活性都比野生型的高,经检查发现一个突变基因中的第139位脯氨酸被丙氨酸替代。
嵌合抗体和人缘化抗体
免疫球蛋白呈Y型,由二条重链和二条轻链通过二硫键相互连接而构成。每条链可分为可变区(N端)和恒定区(C端),抗原的吸附位点在可变区,细胞毒素或其他功能因子的吸附位点在恒定区。每个可变区中有三个部分在氨基酸序列上是高度变化,在三维结构上是处在β折叠端头的松散结构(CDR),是抗原的结合位点,其余部分为CDR的支持结构。不同种属的CDR结构是保守的,这样就可以通过蛋白质工程对抗体进行改造。
鼠单克隆抗体被人免疫系统排斥,它潜在的治疗作用得不到利用。嵌合抗体就是用人抗体的恒定区替代鼠单克隆抗体的恒定区,这样它的免疫原性就显著下降。如用于治疗直肠结肠腺癌(COLORECTALADENOCARCINOMA)的单克隆抗体Mab17-1A。尽管嵌合抗体还存在着免疫原的问题,但仍有几种嵌合抗体通过了临床实验。所谓人缘化抗体就是将抗原吸附区域嫁接到人抗体上,这样抗体上的外源肽链降低到最小,免疫原性也就最小。但是,仅将CDR转接到人抗体上,其抗原吸附能力很小,必须带上几个框架氨基酸残基,才能保持原有的吸附力。这样就存在免疫原性与抗原吸附力之间的矛盾。通过逐个氨基酸替代或计算机模拟分析,可在保持原有吸附力的基础之上,尽可能地降低免疫原性。第一个临床上应用的用于治疗淋巴肉芽肿病和风湿性关节炎的人缘化抗体CAMPATH-1H,尽管疗效显著,但仍有半数以上的患者有免疫反应。而其他人缘化抗体如治疗脊髓性白血病的ANTI-CD33等,其免疫反应可以忽略不计。
蛋白质工程_蛋白质工程 -蛋白质工程进展
当前,蛋白质工程是发展较好、较快的分子工程。这是因为在进行蛋白质分子设计后,已可应用高效的基因工程来进行蛋白的合成。最早的蛋白工程是福什特(Forsht)等在1982―1985年间对酪氨酰―t―RNA合成酶的分子改造工作。他根据XRD(X射线衍射)实测该酶与底物结合部位结构,用定位突变技术改变与底物结合的氨基酸残基,并用动力学方法测量所得变体酶的活性,深入探讨了酶与底物的作用机制。佩里(Perry)1984年通过将溶菌酶中Ile(3)改成Cys(3),并进一步氧化生成 Cys(3)-Cys(97)二硫键,使酶热稳定性提高,显著改进了这种食品工业用酶的应用价值。1987年福什特通过将枯草杆菌蛋白酶分子表面的Asp(99)和Glu(156)改成Lys,而导致了活性中心His(64)质子pKa从7下降到6,使酶在pH=6时的活力提高10倍。工业用酶最佳pH的改变预示可带来巨大经济效益。蛋白工程还可对酶的催化活性、底物专一性、抗氧化性、热变性、碱变性等加以改变。由此可以看出蛋白工程的威力及其光辉前景。上述各例是通过对关键氨基酸残基的置换与增删进行蛋白工程的一类方法。另一类是以某个典型的折叠进行“从头设计”的方法。1988年杜邦公司宣布,成功设计并合成了由四段反平行α―螺旋组成为73个氨基残基的成果。这显示,按人们预期要求,通过从头设计以折叠成新蛋白的目标已是可望又可及了。预测结构的模型法,在奠定分子生物学基础时起过重大作用。蛋白的一级结构,包含着关于高级结构的信息这一点已日益明确。结合模型法,通过分子工程来预测高级结构,已成为人们所瞩目的问题了。
蛋白质工程汇集了当代分子生物学等学科的一些前沿领域的最新成就,它把核酸与蛋白质结合、蛋白质空间结构与生物功能结合起来研究。蛋白质工程将蛋白质与酶的研究推进到崭新的时代,为蛋白质和酶在工业、农业和医药方面的应用开拓了诱人的前景。蛋白质工程开创了按照人类意愿改造、创造符合人类需要的蛋白质的新时期。
蛋白质工程_蛋白质工程 -前景
蛋白质工程取得的进展向人们展示出诱人的前景。例如,科学家通过对胰岛素的改造,已使其成为速效型药品。如今,生物和材料科学家正积极探索将蛋白质工程应用于微电子方面。用蛋白质工程方法制成的电子元件,具有体积小、耗电少和效率高的特点,因此有极为广阔的发展前景。
蛋白质工程_蛋白质工程 -相关词条
基因工程发酵工程酶工程细胞工程微生物工程
蛋白质工程_蛋白质工程 -参考资料
1.http://www.sw51.net/zhishikuozhan/dbzgc.htm
2.新兴研究领域-蛋白质工程
 爱华网
爱华网